
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 将1 L0.5mol/L的浓盐酸加热浓缩为0.5L | |
| D. | 从1000mL 1mol/L NaCl溶液中取出100 mL的溶液 |
分析 A.c=$\frac{n}{V}$中的V是溶液的体积,不是溶剂体积;
B.根据温度、压强对气体摩尔体积的影响分析判断.
C.蒸发过程中HCl会挥发;
D.根据溶液浓度的均一性判断.
解答 解:A.40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液浓度为1mol/L,体积1L应是溶液体积,不是溶剂的体积,故A错误;
B.常温常压下,气体摩尔体积大于22.4L/mol,22.4L HCl的物质的量小于1mol,溶于水配成1L的盐酸溶液,所得溶液浓度小于1mol/L,故B错误;
C.加热浓缩,HCl挥发,盐酸浓度变稀,故C错误;
D.溶液是均匀的,取出溶液的浓度与原溶液浓度相等,故D正确;
故选D.
点评 本题考查学生对物质的量浓度的理解及有关计算,题目难度不大,明确物质的量浓度的表达式为解答关键,C选项为易错点,学生容易忽略氯化氢的挥发.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | ||
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙>丁>戊 | |
| B. | 最高化合价:甲<丁<戊 | |
| C. | 最高价氧化物的水化物的酸性:丙<甲<乙 | |
| D. | 非金属性:乙>丁>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将0.2mol•L-1氨水与0.2mol•L-1盐酸混合,c(NH3•H20)+c(NH4+)=c(Cl-) | |
| B. | 常温下NH4A溶液中的pH=6,则c(A-)-c(NH4+)=9.9×10-7mol•L-1 | |
| C. | c(NH4+)相等的NH4Cl,NH4HCO3溶液中,溶质初始浓度:c(NH4Cl)=c(NH4HCO3) | |
| D. | 将0.2molCO2缓慢通入含有0.3molNAOH的溶液中,c(CO32-)>c(HCO3-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | ||
| A | C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1L 0.1mol•L-1氟化钠溶液中含有F-和HF数目之和为0.1NA | |
| B. | 300mL 2mol/L蔗糖溶液中所含分子数为0.6NA | |
| C. | 标准状况下,1.8gD2O中含有NA个中子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有氯原子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
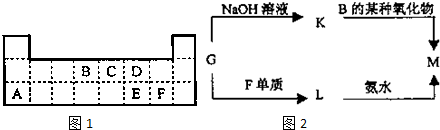
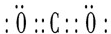 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过澄清石灰水 | |
| B. | 先通过NaHCO3溶液,再通过澄清石灰水 | |
| C. | 通过品红溶液 | |
| D. | 先通过足量的酸性高锰酸钾溶液,再通过澄清石灰水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com