
| A. | 5.6 | B. | 1.6 | C. | 3.2 | D. | 3.6 |
分析 CO在氧气中完全燃烧生成CO2,生成的CO2再与Na2O2反应,有关反应为:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重为CO的质量;H2在氧气中完全燃烧H2O,H2O再与Na2O2反应,有关反应为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重为氢气质量,以此解答.
解答 解:CO在氧气中完全燃烧生成CO2,生成的CO2再与Na2O2反应,有关反应为:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重为CO的质量;H2在氧气中完全燃烧H2O,H2O再与Na2O2反应,有关反应为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重为氢气质量,综上分析,最终固体增重为CO与氢气的总质量,故3.6gCO和H2的混合气点燃后,再通入足量的Na2O2中,充分反应后,固体增重质量是3.6g,故选D.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,难度中等,注意利用差量法从总反应方程式分析固体质量变化,是解答该题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
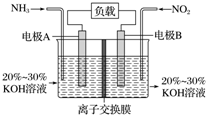 利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )| A. | 电子从右侧电极经过负载后流向左侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 当有4.48 L NH3 (标准状况)反应时,转移电子为0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
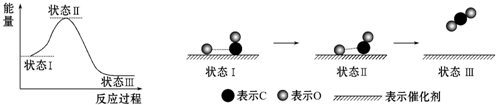
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O反应生成CO2的过程 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应生成CO2的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
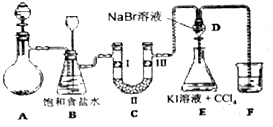
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | Wg该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol | |
| C. | Wg该原子中含有$\frac{W}{a}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量 M=$\frac{22.4mw}{[(1-w)V]}$ | B. | 物质的量浓度 c=$\frac{1000dV}{(MV+22.4m)}$ | ||
| C. | 溶质的质量分数 w=$\frac{MV}{22.4m}$ | D. | 溶液密度 d=$\frac{cM}{1000w}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com