
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g)![]() 2C(g),下列说法说明达到平衡状态的是( )
2C(g),下列说法说明达到平衡状态的是( )
①C的生成速率和C的分解速率相等;
②单位时间内生成a mol A,同时生成3a mol B;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为1∶3∶2;
⑥混合气体的平均相对分子质量不变
A. ②④⑤ B. ①③④⑥ C. ①②④⑥ D. ①②③④⑤
【答案】B
【解析】
对于反应A(S)+3B(g)2C(g),①C的生成速率与C的分解速率相等,表示正、逆反应速率相等,说明反应达到平衡状态,故①正确;②单位时间内生成a mol A是逆反应,同时3a molB也是逆反应,未体现正与逆的关系,故②错误;③密度=![]() ,气体的总质量会变,体积不变,故气体密度不再变化可作为判断是否达到平衡状态的依据,故③正确;④反应前后气体的体积不等,故混合气体的总压强不再变化,可作为判断是否达到化学平衡状态的依据,故④正确;⑤平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,故A、B、C的物质的量比为1:3:2不能作为判断是否达到平衡状态的依据,故⑤错误;⑥反应前气体平均相对分子质量=A的相对分子质量,完全反应后气体平均相对分子质量=B的相对分子质量,二者不等,平衡时,A、B的物质的量比例不变,混合气体的平均相对分子质量不变,可作为判断是否达到化学平衡状态的依据,故⑥正确;说法正确的是①③④⑥,故选B。
,气体的总质量会变,体积不变,故气体密度不再变化可作为判断是否达到平衡状态的依据,故③正确;④反应前后气体的体积不等,故混合气体的总压强不再变化,可作为判断是否达到化学平衡状态的依据,故④正确;⑤平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,故A、B、C的物质的量比为1:3:2不能作为判断是否达到平衡状态的依据,故⑤错误;⑥反应前气体平均相对分子质量=A的相对分子质量,完全反应后气体平均相对分子质量=B的相对分子质量,二者不等,平衡时,A、B的物质的量比例不变,混合气体的平均相对分子质量不变,可作为判断是否达到化学平衡状态的依据,故⑥正确;说法正确的是①③④⑥,故选B。


科目:高中化学 来源: 题型:
【题目】实验室可以用下图所示的装置制取乙酸乙酯。回答下列问题:
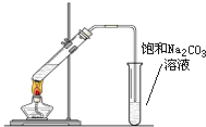
(1)在试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液,其方法是:_______;
(2)乙酸乙酯在饱和碳酸钠溶液的_______层;(填“上”或“下”)
(3)浓硫酸的作用是______________;
(4)制取乙酸乙酯的化学方程式是______,该反应属于___ (填反应类型)反应;
(5)饱和碳酸钠的作用是:________________;
(6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_________。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol 乙醇。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。电池总反应为:2CH3OH+3O2→2CO2+4H2O。下列说法正确的是( )

A. 左电极为电池的负极,a处通入的物质是空气
B. 右电极为电池的负极,b处通入的物质是甲醇
C. 负极反应式为:CH3OH+H2O-6e-= CO2+6H+
D. 正极反应式为:O2+2H2O -4e-= 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,1 mol H2和1 mol O2,下列有关它们的说法正确的是
A. 质量相同,体积不同 B. 分子数相同,质量不同
C. 体积相同,分子数不同 D. 体积相同,原子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束通过下列物质时,会出现丁达尔效应的是:①消毒用的酒精 ②Fe(OH)3胶体 ③生理食盐水 ④有色玻璃 ⑤云、雾
A.②④⑤B.③④⑤C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 已知t1 ℃时,反应C+CO2![]() 2CO ΔH>0的速率为v,若升高温度逆反应速率减小
2CO ΔH>0的速率为v,若升高温度逆反应速率减小
B. 恒压容器中发生反应N2+O2![]() 2NO,若在容器中充入He,正逆反应的速率均不变
2NO,若在容器中充入He,正逆反应的速率均不变
C. 当一定量的锌粉和过量的6 mol·L-1盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向反应器中加入一些水、CH3COONa溶液或NaNO3溶液
D. 对任何一个化学反应,温度发生变化,化学反应速率一定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应中,属于氧化还原反应的是
A.Cu2++2OH-= Cu(OH)2↓B.H++OH- =H2O
C.2H++CO32-=H2O+CO2↑D.Cu2++Fe=Fe2++ Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L的密闭容器中,发生反应4A(s)+3B(g)![]() 2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.4 mol·L-1·min-1
B. 用BCD分别表示反应的速率,其比值是3∶2∶1
C. 在第2 min末的反应速率用B表示是0.3 mol·L-1·min-1
D. 在这2 min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com