
【题目】化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应的热化学方程式是
2NH3的能量变化如图所示,该反应的热化学方程式是

A. N2(g)+3H2(g)![]() 2NH3(l) △H= 2(a﹣b﹣c)kJ/mol
2NH3(l) △H= 2(a﹣b﹣c)kJ/mol
B. N2(g)+3H2(g)![]() 2NH3(g)△H=2(b﹣a)kJ/mol
2NH3(g)△H=2(b﹣a)kJ/mol
C. 0.5N2(g)+1.5H2(g)![]() NH3(l)△H=(b+c﹣a)kJ/mol
NH3(l)△H=(b+c﹣a)kJ/mol
D. 0.5N2(g)+1.5H2(g)![]() NH3(g)△H=(a+b)kJ/mol
NH3(g)△H=(a+b)kJ/mol
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10 mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
A. CO.H2S的转化率之比为1:1
B. 达平衡后H2S的体积分数为4%
C. 升高温度,COS浓度减小,表明该反应是吸热反应
D. 恒温下向平衡体系中再加入CO.H2S.COS.H2各1 mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:

请回答下列问题:
(1)盛装双氧水的化学仪器名称是__________。
(2)如何检验该套装置的气密性__________________________________________________。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而__________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入______g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确_________________,理由是_________________________________________________。(提示:H2O2的密度可认为近似相等)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为: 2H2+O2=2H2O,下列有关说法错误的是

A. 电子通过外电路从a极流向b极
B. b极上的电极反应式为:O2+4H++4e-=2H2O
C. H+由b极通过固体酸电解质传递到a极
D. 每转移0.1 mol电子,标准状况下需消耗1.12 L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
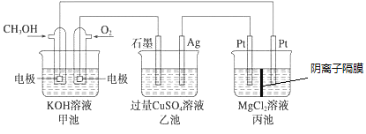
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使溶液恢复原浓度
D. 甲池中消耗4.48L(标准状况下)O2,此时丙池中理论上最多产生23.2 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳纶可以制成防弹衣、防弹头盔、防弹装甲等,对位芳纶纤维J(聚对苯二甲酰对苯二胺)是重要的国防军工材料。化合物A、乙烯、苯制备J的一种合成路线如下:

回答下列问题:
(1)A的化学名称为____________________。
(2)A→B的反应类型是____________________。
(3)实验室由苯制备F所需试剂、条件分别为____________________。
(4)G中官能团的名称是____________________。
(5)E与I反应生成J的化学方程式为____________________。
(6)写出与D互为同分异构体的只含酯基的结构简式(核磁共振氢谱为四组峰,峰面积比为2:2:1:1____________________。
(7)参照上述合成路线,以1,3-戊二烯和丙烯为原料(无机试剂任选),设计制备邻苯二甲酸的合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将甲烷和二氧化碳一步转化为具有高附加值的液体燃料和化工产品。回答下列问题:
(1)已知:甲烷和乙酸的燃烧热△H分别为-890.31kJ·mol-1、-876.72kJ·mol-1,试写出甲烷与CO2合成乙酸的热化学方程式:______________。
(2)甲烷和二氧化碳一步转化为液体产品的选择性如下图所示,其中选择性最高的产品是___________,反应中应加入的等离子体催化剂是___________。

(3)在某一钢性密闭容器中CH4、CO2的分压分别为25kPa、30kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率υco=1.28×10-2·p(CH4)·p(CO2) (mol·g-1·s-1),某时刻测得p(H2)=20kPa,则p(CH4)= ____kPa,υco=___mol·g-1·s-1。
②达到平衡后测得体系总压是起始时的1.8倍,则该反应的平衡常数Kp=________(kPa)2(计算结果保留两位有效数字)。
③温度对产物流量及平衡转化率的影响如图所示,可知反应△H____0(填“>”或“<”),原因是_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com