
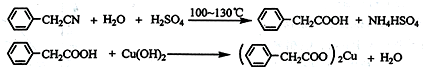
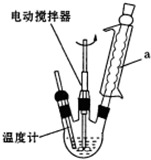
分析 (1)由图可知,a为冷凝管,可冷凝回流产物;
(2)由信息可知,微溶于冷水,则冷水降低其溶解度,然后过滤分离;
(3)将苯乙酸粗品进一步提纯,结合苯乙酸的熔点为76.5℃,可升华分析;
(4)用蒸馏水洗涤沉淀,若洗涤干净,表面不含氯离子;
(5)混合溶剂中乙醇可增大苯乙酸的溶解.
解答 解:(1)由图可知,a为球形冷凝管,其作用是冷凝回流,防止苯乙酸的挥发而降低产品产率,
故答案为:球形冷凝管;冷凝回流,防止苯乙酸的挥发而降低产品产率;
(2)由信息可知,微溶于冷水,则冷水降低其溶解度,加入冷水的目的是便于苯乙酸结晶析出,然后过滤分离,过滤需要烧杯、漏斗、玻璃棒,
故答案为:便于苯乙酸结晶析出; BCE;
(3)苯乙酸的熔点为76.5℃,可升华,且苯乙酸微溶于冷水,溶于乙醇,则将苯乙酸粗品进一步提纯,选择的实验方法是重结晶、升华,
故答案为:重结晶、升华;
(4)用蒸馏水洗涤沉淀,若洗涤干净,表面不含氯离子,则判断沉淀洗干净的实验操作和现象是取少量最后一次洗涤液于试管中,加入稀硝酸,再加AgNO3溶液,无白色沉淀(或白色浑浊)出现,
故答案为:取少量最后一次洗涤液于试管中,加入稀硝酸,再加AgNO3溶液,无白色沉淀(或白色浑浊)出现;
(5)混合溶剂中乙醇的作用是增大苯乙酸溶解度,便于充分反应,故答案为:增大苯乙酸溶解度,便于充分反应.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、实验操作、物质的性质及混合物分离提纯、离子检验等为解答的关键,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:填空题
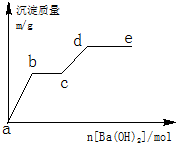 在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.
在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中KMnO4被氧化 | |
| B. | 反应中得到电子的物质是Cl2 | |
| C. | 每生成1 mol Cl2时,反应中转移的电子为2 mol | |
| D. | 被还原的HCl占参加反应HCl物质的量的3/8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可用FeCl3溶液鉴别化合物I和II | |
| B. | 物质I在NaOH醇溶液中加热可发生消去反应 | |
| C. | 物质II中所有原子可能位于同一平面内 | |
| D. | 物质III与足量H2加成所得产物分子中有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 工业上,三者的单质目前都使用热还原法制得 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去除油污能力更强 | |
| B. | NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火器 | |
| C. | 保存FeSO4溶液时加入少量铁粉 | |
| D. | 把AlCl3溶液加热蒸干灼烧至质量不再变化得到Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com