
| A.1:3 | B.3:1 | C.1:4 | D.1:1 |
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源:不详 题型:填空题
 CH3OH (g) △H 1(反应Ⅰ)
CH3OH (g) △H 1(反应Ⅰ)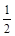 O2(g)=CO2(g) △H 2=-283 kJ·mol-
O2(g)=CO2(g) △H 2=-283 kJ·mol- 1 (反应Ⅱ)
1 (反应Ⅱ)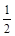 O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)| 化学键 | C-C | C-H | H-H | C-O | C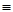 O O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
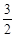 O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4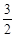 O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下: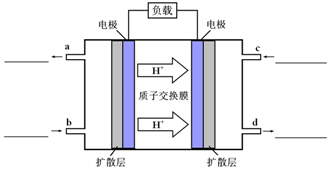
 学式)
学式)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |
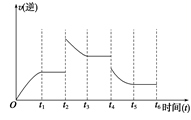
| A.升温 | B.降温 | C.降压 | D.移去部分反应物 E.加入负催化剂 |
| 实验 编号 | 温度/K | 盐酸浓度 /mol·L-1 | 醋酸浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.20 | | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
| ② | 308 | 0.20 | | |
| ③ | 298 | 0.40 | | |
| ④ | | 0.20 | 0.20 | |
| ⑤ | | | |
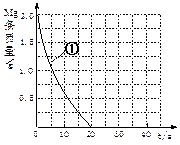
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: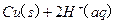 ====
====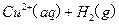
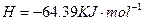
 ====
====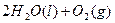
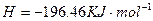
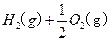 ="==="
="===" 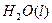
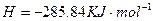
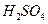 溶液中
溶液中 与
与 反应生成
反应生成 和
和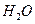 的热化方程式为 。
的热化方程式为 。 和3.0
和3.0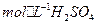 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 ( 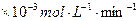 )[:.....] )[:.....] | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
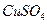 溶液中加入一定量的
溶液中加入一定量的 和
和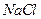 溶液,加热,生成
溶液,加热,生成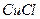 沉淀。制备
沉淀。制备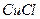 的离子方程式是 。
的离子方程式是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H1>△H2>△H3 | B.△H2>△H3>2△H1 |
| C.△H2>△H1>△H3 | D.△H3>△H2>2△Hl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 催化剂 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+ 488.3 kJ/mol | B.-488.3 kJ/mol |
| C.-244.15 kJ/mol | D.+ 244.15 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
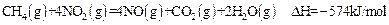
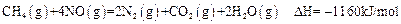

| A.等物质的量的CH4参加反应,反应①②转移的电子数相同 |
| B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);⊿H=-618KJ/mol |
| C.0.2 mol CH4还原NO2至N2,且生成H2O(g)放出的热量为173.4kJ |
| D.若用4.48 L(标准状况)CH4还原NO2至N2,整个过程中转移电子1.60mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com