
分析 (1)根据每生成23gNO2即0.5molNO2需要吸收16.95kJ热量,结合热化学方程式的书写方法结合热化学方程式的意义来回答;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
解答 解:(1)适量的N2和O2完全反应,每生成23克NO2即0.5molNO2要吸收16.95kJ热量,所以每生成2molNO2需要吸收67.8kJ热量,则热化学方程式为:
N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1,故答案为:N2(g)+2O2(g)=2NO2(g)△H=67.8kJ•mol-1;
(2)在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,
所以热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1;
(3)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
点评 本题主要考查了热化学方程式的书写,注意把握从键能的角度计算反应热的方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中PM2.5值越高,大气污染越严重,由PM2.5引起的雾霾不一定属于胶体 | |
| B. | 装饰材料释放的苯、甲苯、甲醛等易挥发性烃类物质会导致室内空气污染 | |
| C. | 加热能杀死H7N9型禽流感病毒,是因为病毒的蛋白质受热变性 | |
| D. | 石墨烯(由石墨剥离而成的层状结构)可用于制造超级计算机,因其具有优异的导电性能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 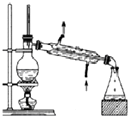 装置常用于分离互不相溶的液体混合物 装置常用于分离互不相溶的液体混合物 | |
| B. | 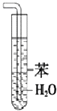 装置可用于吸收氨气,且能够防止倒吸 | |
| C. | 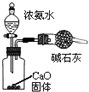 装置可用于制备少量NH3 | |
| D. | 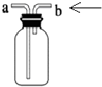 装置可用于收集O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含Cl2和H2O 分子 | |
| B. | 新制氯水可使蓝色石蕊试纸变红且不褪色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 氯水放置数天后酸性将变强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431 kJ•mol-1 | B. | 946 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 1130 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 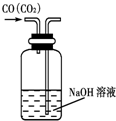 除去CO气体中的CO2气体 | B. | 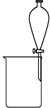 分 分离碘酒中的碘和酒精 | ||
| C. | 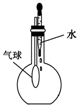 验证NH3的溶解性 | D. | 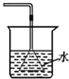 吸收HCl防倒吸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com