
【题目】已知:2X(g)+Y(g)![]() 2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
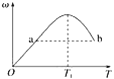
A. T1时,v正>v逆
B. 正反应的ΔH<0
C. a、b两点的反应速率v(a)=v(b)
D. 当温度低于T1时,ω增大的原因是平衡向正反应方向移动
【答案】B
【解析】
当可逆反应达到化学平衡状态时,反应物的转化率最大,产物的产率也最高,由此可以判断0-T1阶段是化学平衡的建立过程,以后是温度对化学平衡的影响情况,根据化学平衡的建立过程以及温度对化学平衡的影响知识来解决。
当可逆反应达到化学平衡状态时,产物Z的生成率最大,物质的量分数最大,所以在T1时刻,化学反应达到了平衡状态。
A.T1时,化学反应达到了平衡状态,v正=v逆,A项错误;
B. 当温度高于T1时,Z的物质的量分数逐渐减小,所以化学平衡逆向移动,即逆反应方向是吸热的,所以正反应是一个放热反应,即△H<0,B项正确;
C. 温度越高,化学反应速率越大,b点温度高于a点,所以b的速率高于a点的速率,即v(a)< v(b),故C错误;
D.0T1阶段是化学平衡的建立过程,反应开始向右不断进行,生成的Z的量越来越大,所以ω增大,D项错误;
答案选B。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】乙酸和乙醇反应制取乙酸乙酯的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上。回答下列问题:
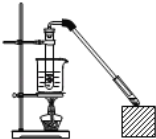
(1)乙酸的官能团是____(写名称)。制取乙酸乙酯的化学方程式为:___。
(2)①浓H2SO4的作用是____。
②小试管中的溶液是____,其作用是____(写出一种即可);
③长导管不插入液面以下的目的是____;
(4)实验中采取的加热方式称,这种加热方式的好处主要有____、___;
(5)反应生成的乙酸乙酯,其密度比水___(填“大”或“小”),有___气味。应从该分液漏斗的___(填编号,多填、少填均不得分)。
a.下部流出 b.上口倒出 c.都可以
(6)若实验室中温度过高,温度达170℃,副产物中主要有机产物是___(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量混合气体在密封容器中发生如下反应:xA(g)+yB(g)![]() nC(g)。达到平衡后测得A气体的浓度为0.5mol/L;保持恒温下将密闭容器的容积扩大1倍,再达到平衡时,测得A的浓度为0.3 mol/L。则下列叙述正确的是
nC(g)。达到平衡后测得A气体的浓度为0.5mol/L;保持恒温下将密闭容器的容积扩大1倍,再达到平衡时,测得A的浓度为0.3 mol/L。则下列叙述正确的是
A.x+y<nB.该化学平衡向右移动
C.B的转化率增大D.A的物质的量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:BF3和水反应生成氟硼酸(HBF4)和硼酸(H3BO3),一定条件下BF3与一定量水可形成![]() 晶体Q(
晶体Q(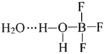 )。下列有关说法,正确的是
)。下列有关说法,正确的是
A.BF3和水反应生成氟硼酸和硼酸是氧化还原反应
B.BF3分子中,每个原子的最外层都具有8电子稳定结构
C.晶体Q中存在离子键、共价键、范德华力和氢键
D.H3BO3在水中只发生反应:![]() ,可知硼酸是一元酸
,可知硼酸是一元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
物质 | X | Y | Z |
初始物质的量/mol | 0.2 | 0.2 | 0 |
平衡物质的量/mol | 0.1 | 0.05 | 0.1 |
下列说法正确的是( )
A.反应可表示为![]() ,其平衡常数为8 000
,其平衡常数为8 000
B.增大压强使平衡向生成Z的方向移动,则平衡常数增大
C.若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D.若升高温度,Z的浓度增大,则温度升高时![]() 正增大,
正增大,![]() 逆减小
逆减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
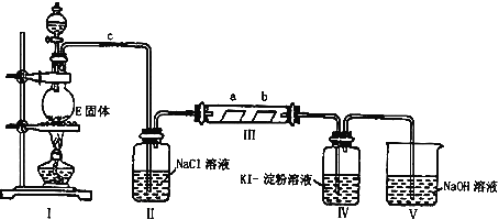
(1)有关氯气、氯水和氯离子的性质,下列说法正确的是___。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.Cl-和Cl2都具有很强的氧化性
C.新制氯水可以用来杀菌消毒是因为生成强酸次氯酸
D.将新制氯水滴入AgNO3溶液,会出现白色沉淀
(2)装置Ⅱ中饱和食盐水的作用是___。
(3)实验室以二氧化锰和浓盐酸制备氯气的离子方程式为:___。
(4)实验过程中,装置IV中的实验现象为__;发生反应的化学方程式为__。
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加如图中的__装置![]() 填序号
填序号![]() ,该装置的作用是__。
,该装置的作用是__。

(6)装置Ⅴ的目的是防止尾气污染,写出装置Ⅴ中发生反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑下列说法正确的是( )
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用下列装置设计一个实验,证明Cl2的氧化性比I2的氧化性强。
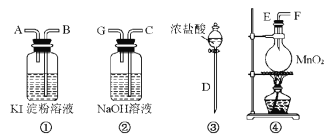
请回答下列问题:
(1)若气流从左到右,则上述仪器的连接顺序为D接E,______接_____,_____接____。
(2)圆底烧瓶中发生反应的化学方程式为____________。
(3)证明Cl2比I2的氧化性强的实验现象是_____________,反应的离子方程式是________。
(4)装置②的作用是___________。
(5)若要证明Cl2的氧化性比Br2强,则需做的改动是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为从海带中提取碘,某研究性学习小组设计并进行以下实验:
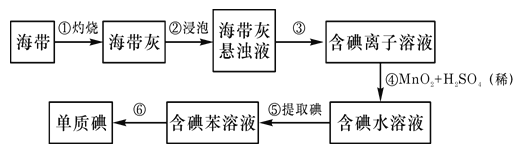
请填写下列空白:
(1)步骤③中过滤操作时,除需要铁架台、烧杯等,还需用到的玻璃仪器是___。
(2)步骤④中反应的离子方程式是___。
(3)步骤⑤和⑥的实验操作名称分别是___和____。
(4)步骤⑤中,某学生选择用CCl4来提取碘的理由是:CCl4与碘单质不反应,___。
(5)酸性条件下,若用IO3-将I-氧化为I2,则I-和IO3-的物质的量之比为___。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com