
| A. | 四氯化碳的电子式 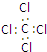 | B. | 乙炔的最简式 CH≡CH | ||
| C. | 聚乙烯的结构简式为 CH2=CH2 | D. | 丙烷的分子结构模型示意图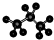 |
分析 A.四氯化碳的电子式中漏掉了氯原子的最外层的3对孤电子对;
B.最简式为分子中各原子的最简比;
C.聚乙烯为高分子化合物,是有乙烯通过加聚反应生成的;
D.丙烷分子中存在2个甲基、1个亚甲基.
解答 解:A.四氯化碳为共价化合物,碳原子和Cl原子最外层都达到8个电子,四氯化碳正确的电子式为: ,故A错误;
,故A错误;
B.乙炔的最简式为C、H最简比,乙炔的最简式为CH,故B错误;
C.聚乙烯为乙烯通过加聚反应生成的,其正确的结构简式为: ,故C错误;
,故C错误;
D.C原子半径大于氢原子, 为丙烷的球棍模型,故D正确;
为丙烷的球棍模型,故D正确;
故选D.
点评 本题考查了化学用语的判断,题目难度中等,涉及结构简式、电子式、比例模型、最简式等知识,注意掌握常见化学用语的概念及表示方法,试题侧重考查学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 铝与V2O5发生铝热反应 | B. | 镁粉投入到FeCl3溶液中 | ||
| C. | 碳粉与CuO混合物在试管中加热 | D. | 水蒸气通入足量Na2O2粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| PH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7.30的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 | |
| B. | 人体血液酸中毒时,可注射NaHCO3溶液缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)<c(HCO3-) | |
| D. | 正常人体血液中,HCO3-的水解程度大于它的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
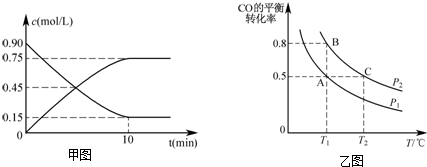
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| B. | 2.8g[CH2 CH2]n 中含有的碳原子数为0.2NA | |
| C. | 1mol苯分子中含有C=C双键数为3NA | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成水分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
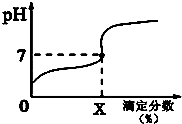 常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )| A. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{c({A}^{-})}$的值减小 | |
| B. | HA的电离常数KHA=$\frac{1{0}^{-7}X}{100-X}$(x为滴定分数) | |
| C. | 当滴定分数为100时,溶液中水的电离程度最大 | |
| D. | 滴定分数大于100时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
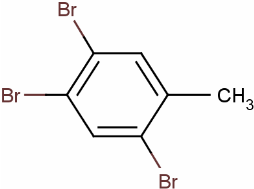 +3HBr.
+3HBr.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com