
A、硝基苯的结构简式为 |
B、表示甲烷分子或四氯化碳分子的比例模型 |
| C、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 |
D、结构片段为 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
 可以表示甲烷的比例模型;四氯化碳中Cl原子的原子半径大于C原子;
可以表示甲烷的比例模型;四氯化碳中Cl原子的原子半径大于C原子; 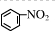 ,故A错误;
,故A错误; ,故D正确;
,故D正确;

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
| A、V3>V2>V1 |
| B、V3=V2=V1 |
| C、V3>V2=V1 |
| D、V1=V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 实验序号 | 铁锈质量/g | 氧化铁质量/g |
| ① | 0.856 | 0.640 |
| ② | 1.424 | 1.280 |
| ③ | 0.979 | 0.880 |
| ④ | 1.070 | 0.800 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3?H2O溶液,滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3?H2O溶液,滴定曲线如图.下列说法正确的是( )| A、①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| B、②溶液:c(NH4+)=c(C1-)>c(OH-)=c(H+) |
| C、③溶液:c(OH-)>c(H+) |
| D、滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- |
| B、能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br- |
| C、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D、pH为13的溶液:CO32-、SO32-、S2O32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吸引电子能力的大小顺序一定为Z>Y>W |
| B、原子半径的大小顺序一定为X>Y>Z>W |
| C、Y、Z形成的分子的空间构型可能是正四面体 |
| D、原子核外未成对电子数可能是Z>Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、IClO |
| B、ICl3 |
| C、I2Cl6 |
| D、KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次序 | 温度(℃) | 冷却后剩余固体的质量(g) |
| 1 | 102 | 6.848 |
| 2 | 113 | 5.696 |
| 3 | 258 | 5.120 |
| 4 | 570 | 2.560 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制备乙酸乙酯时,将乙醇和乙酸依次倒入到浓硫酸中 |
| B、用干燥且沽净的玻璃棒蘸取待测液滴到放在表面皿上的pH试纸上 |
| C、滴定管洗净后,经蒸馏水润洗即可注入标准液进行滴定 |
| D、铜片跟稀硝酸反应产生的气体可用排水法收集 |
| E、用浓氨水洗涤做过银镜反应的试管 |
| F、在溴水中滴入少量苯酚溶液有白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com