
| A、容器内气体颜色变深,平均相对分子质量不变 |
| B、平衡不移动,混合气体密度增大 |
| C、H2转化率增大,HI平衡浓度变小 |
D、 改变条件前后,速率图象为(如图) |


科目:高中化学 来源: 题型:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| 体系中各物质 | CO | H2 | CH3OH |
| 物质的量浓度(mol/L) | 0.1 | 0.2 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol?L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol?L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol?L-1) | 1 | 2.5 | 3 | 3 |
| A、在t3时刻反应已经停止 |
| B、A的转化率比B的转化率低 |
| C、该温度下此可逆反应平衡常数K=4 |
| D、该反应的化学方程式为2A(g)+B(g)?C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
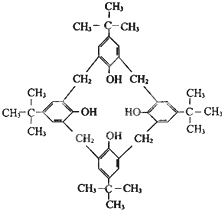 杯芳烃因分子形状与希腊圣杯相似而得名,对“特丁基杯芳烃”的结构简式如图所示,下列说法不正确的是( )
杯芳烃因分子形状与希腊圣杯相似而得名,对“特丁基杯芳烃”的结构简式如图所示,下列说法不正确的是( )| A、分子式是C40H54O4 |
| B、既能发生氧化反应,也与氢氧化钠溶液反应 |
| C、至少有9个碳原子在同一个平面上 |
D、可由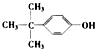 与HCHO缩合而成 与HCHO缩合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
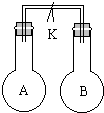 如图所示,室温下,两个容积相等的烧瓶中分别集满了A和B两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
如图所示,室温下,两个容积相等的烧瓶中分别集满了A和B两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )| 编号 | ① | ② | ③ | ④ |
| A中气体 | H2S | H2 | NH3 | NO |
| B中气体 | SO2 | O2 | HCl | O2 |
| A、②③④① | B、③①④② |
| C、③②①④ | D、④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 仪器 | 药品 |
| A | 配制1mol/LNaCl溶液 | 烧杯、玻璃棒、容量瓶、胶头滴管 | 氯化钠、水 |
| B | 粗盐提纯 | 烧杯、玻璃棒、长颈漏斗、酒精灯、蒸发皿 | 粗盐、水 |
| C | 萃取碘水中的碘 | 烧杯、分液漏斗 | 碘水、乙醇 |
| D | 检验集气瓶中的气体是氧气 | 集气瓶(带玻璃片) | 带火星的木条 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、80g硝酸铵中含有氮原子数为NA |
| B、0.lmolN5+离子中所含的电子数为3.4NA |
| C、1mol甲烷和NA个甲烷分子的质量相等 |
| D、16g氧气和16g臭氧所含的原子数均为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com