
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
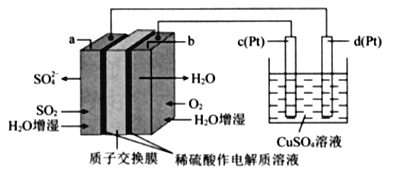
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
【答案】D
【解析】
燃料电池:a端:二氧化硫生成硫酸根离子,硫元素化合价升高失电子所以a为负极,电极反应式SO2+2H2O-4e-=SO42-+4H+;b为正极,电极反应式为O2+4H++4e-=2H2O,总电极反应式2SO2+O2+2H2O=2H2SO4。电解池:c极和电源正极相连为阳极,失电子,电极反应式为4OH—-4e-=2H2O+O2↑,d极与电源负极相连为阴极,得电子,电极反应式为Cu2++2e+=Cu,总电极反应式为2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑。
2Cu+2H2SO4+O2↑。
A. b为正极,看到质子交换膜确定酸性环境,电极反应式为O2+4H++4e-=2H2O,故不选A;
B.原电池内部阳离子向正极移动,阴离子向负极移动,故不选B;
C.由上面分析可知该燃料电池的总反应为2SO2+O2+2H2O=2H2SO4,故不选C;
D.d极与电源负极相连,为阴极得电子,有铜析出,所以应该是若a电极消耗标况下2.24LSO2,理论上在d极上有6.4g铜析出,故选D;
正确答案:D。


科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的数值为NA,下列说法正确的是
A.1molS与足量Fe反应,转移的电子数为3NA个
B.1.5 mol NO2与足量H2O反应,转移的电子数为2NA个
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA个
D.100 ml 0.10mol /L的氨水中,含NH3·H2O 分子0.01NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于同温同压下等质量的CO和CO2,下列叙述正确的是( )
A. 体积之比为2∶1 B. 体积之比为7∶1
C. 所含原子数之比为22∶21 D. 密度之比为11∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 标况下,11.2L氟化氢中含有的电子数5NA
B. 6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
C. 100mL 0.1mol/L 的KAl(SO4)2溶液中含有的阳离子总数为0.02NA
D. 分别由H2O2和KMnO4制备等量的氧气转移的电子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 甲烷和苯都是重要的化工原料,可从石油分馏中获得
B. 淀粉、菜籽油和蛋白质都是天然高分子化合物
C. 室温下,在水中的溶解度:乙醇大于溴乙烷
D.  苯乙烯在一定条件下可加聚反应,不可以发生取代反应
苯乙烯在一定条件下可加聚反应,不可以发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像不符合反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第____周期___族
(2)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的离子方程式是________________。
(3)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O ii: ……
① 写出ii的化学方程式:_________________________。
② 请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入__________溶液,溶液无颜色变化,再加入少量PbO2,溶液变为________色。
b.向a得到的溶液中加入___________________,溶液恢复原来的颜色。
(4)过程II中过滤操作所需要的玻璃仪器有__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应式为___________________。
(2)装置2中左池为氯化铁溶液,右池为硫酸铜溶液,一段时间后右池溶液中c(Cu2+)_________(填“增大”、“减小”或“不变”),若该装置的盐桥中盛装的是NH4NO3的琼脂溶液,则盐桥中的_____离子(填“NH4+”或“NO3-”)向氯化铁溶液迁移。
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液。反应一段时间后,观察到乙烧杯的石墨电极上有气泡生成。
①电源的M端为___极;甲烧杯中铁电极的电极反应式为_______________。
②乙烧杯中电解反应的离子方程式为__________________________________。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.32g,甲烧杯中产生的气体标准状况下体积为________mL;电解后乙烧杯溶液的pH为______(假设电解前后溶液的体积不变)。
④若要将乙池设计成电解精炼铜的装置,则乙池的石墨应改成_____(填“粗铜”或“精铜”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是

A. C制的容器可盛装A和D的最高价含氧酸的浓溶液
B. AE3、D2E2分子中所有原子最外层均达到8电子结构
C. B、D、E的单质或者化合物中都可能有能作漂白剂的物质
D. 工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com