
| A. | 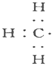 --甲基的电子式 --甲基的电子式 | B. | 甲烷的结构式:CH4 | ||
| C. | CH3-CH=CH-CH3的键线式: | D. | 苯的分子式: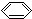 |
分析 A.甲基中含有3个碳氢键,碳原子最外层为7个电子;
B.用短线代替所有共用电子对为结构式,CH4为甲烷的分子式或结构简式;
C.将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有1个碳原子,称为键线式,据此判断该有机物的键线式;
D.分子式只表示分子中各原子组成,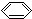 为苯的结构简式.
为苯的结构简式.
解答 解:A.甲基中含有3个碳氢共用电子对,碳原子的最外层为7个电子,甲基的电子式为: ,故A正确;
,故A正确;
B.CH4为甲烷的分子式、结构简式,甲烷正确的结构式为: ,故B错误;
,故B错误;
C.CH3-CH=CH-CH3为2-丁烯,其键线式为: ,故C正确;
,故C正确;
D. 为苯的结构简式,苯的分子式为C6H6,故D错误;
为苯的结构简式,苯的分子式为C6H6,故D错误;
故选AC.
点评 本题考查了常见化学用语的书写判断,题目难度中等,涉及结构式、电子式、键线式、结构简式与分子式等知识,明确常见化学用语的概念及书写原则为解答根据,试题培养了学生的规范答题能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
 为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| N2(mol•L-1) | H2(mol•L-1) | NH3(mol•L-1) | |
| 起始时 | 3 | 3 | 0 |
| 2s末 | 2.6 | 1.8 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

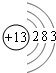 ,它的单质能(填能或不能)与氢氧化钠溶液反应.
,它的单质能(填能或不能)与氢氧化钠溶液反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 分子中只有共价键的物质一定是共价化合物 | |
| D. | 非金属元素不能组成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol SO2与1 mol O2能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率 | |
| B. | 2 mol SO2与1 mol O2不能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率 | |
| C. | 2 mol SO2与1 mol O2能完全反应生成2 mol SO3,升高温度减慢此反应的化学反应速率 | |
| D. | 2 mol SO2与1 mol O2不能完全反应生成2 mol SO3,升高温度减慢此反应的化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列1mol化学键需要吸收的能量分别为:P-P a kJ、P-O b kJ、P=O c kJ、O=O d kJ.根据下图所示的分子结构和有关数据估算1mol P4发生该反应放出的热量是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列1mol化学键需要吸收的能量分别为:P-P a kJ、P-O b kJ、P=O c kJ、O=O d kJ.根据下图所示的分子结构和有关数据估算1mol P4发生该反应放出的热量是( )| A. | (6a+5d-4c-12b) kJ | B. | (4c+12b-6a-5d) kJ | C. | (4c+12b-4a-5d) kJ | D. | (5a+5d-4c-12b) kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com