
| A. | CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 | |
| B. | Al3++3H2O?Al(OH)3+3H+ 明矾净水 | |
| C. | Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ 制备Fe(OH)3胶体 | |
| D. | SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
分析 A.水解分步进行,以第一步水解为主;
B.铝离子水解生成胶体可净化水;
C.铁离子水解制备胶体;
D.加NaOH与盐酸反应,促进水解.
解答 解:A.水解分步进行,以第一步水解为主,则CO32-+H2O?HCO3-+OH-用于热的纯碱溶液清洗油污,故A正确;
B.Al3++3H2O?Al(OH)3+3H+,生成胶体,则明矾净水,故B正确;
C.铁离子水解制备胶体,Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+用于制备Fe(OH)3胶体,故C正确;
D.加NaOH与盐酸反应,促进水解,则配制氯化亚锡溶液时加入盐酸抑制水解,故D错误;
故选D.
点评 本题考查离子反应书写的正误判断,为高频考点,把握常见离子之间的反应为解答的关键,侧重水解反应的离子反应考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 12C、13C、14C、C60都是碳元素的同位素 | |
| B. | 同种元素的原子,质量数一定相同 | |
| C. | 互为同位素的原子,质子数一定相同 | |
| D. | 由一种元素组成的物质,一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和H2SO4 | B. | NaHSO4和Ba(OH)2 | C. | NaAlO2和H2SO4 | D. | AlCl3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验观察 | 离子方程式 | 解释与结论 |
| ① | 在FeCl2溶液中 滴入适量氯水 | 溶液由浅绿色 变为黄色 | 2Fe2++Cl2═2Fe3++2Cl- | Fe2+具有还原性 |
② | 在FeCl2溶液中 加入锌片 | / | Zn+Fe2+=Zn2+ +Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中 加入足量铁粉 | 溶液由黄色变成浅绿色 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 |
④ | 在FeCl3溶液中 通入H2S气体 | 溶液变为浅绿色并 有淡黄色沉淀生成 | H2S+2Fe3+=2Fe2++S↓+2H+ | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
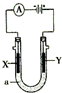 电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )
电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.下列正确的是( )| A. | 若X、Y为石墨,a为饱和NaCl溶液,向Y极附近加入酚酞,则Y极溶液呈红色 | |
| B. | 若X、Y是石墨,a为AgNO3溶液,电解一段时间后,溶液的pH减小 | |
| C. | 若用电解方法精炼粗铜,电解液a选用CuSO4溶液,X电极的材料是粗铜 | |
| D. | 若Y为铁,X为石墨,a为稀硫酸,Y电极反应为Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与少量乙二醛混合可制备乙二酸 | |
| B. | 与浓盐酸反应的离子方程式为:2MnO4-+16 H++10Cl-=5Cl2↑+2Mn2++8 H20 | |
| C. | 与K+、NO3-、SO42-、CO32-可以大量共存 | |
| D. | 与过量Na202混合后,共转移e-0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| D. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com