
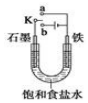
 某课外活动小组同学用如图装置进行实验,试回答下列问题
某课外活动小组同学用如图装置进行实验,试回答下列问题分析 (1)若开始时开关K与a连接,则形成原电池反应,为铁的吸氧腐蚀;
(2)若开始时开关K与b连接,形成电解池装置,石墨为阳极,发生氧化反应生成氯气,能使湿润的KI淀粉试纸变蓝,铁为阴极,发生还原反应生成氢气和氢氧化钠,以此解答.
解答 解:(1)开始时开关K与a连接,是原电池,铁为负极,发生氧化反应,失去电子生成亚铁离子,电极方程式为Fe-2e-=Fe2+,A极上氧气得电子被还原,电极方程式为O2+2H2O+4e-=4OH-,为铁的吸氧腐蚀;
故答案为:吸氧;
(2)开关K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气,总反应式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,2H2O+2Cl- $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;
故答案为:2H2O+2Cl- $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-.
点评 本题综合原电池和电解质知识,侧重于学生的分析能力和电化学知识的综合应用,注意解题时要注意分析电极反应及生成物,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质在体内代谢的最终产物是硝酸 | |
| B. | 灼烧蛋白质没有明显现象 | |
| C. | 误食重金属盐会使人中毒,应立即喝牛奶、豆浆解毒 | |
| D. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
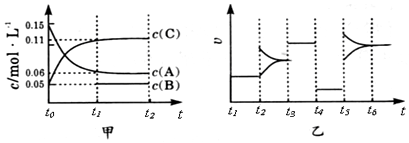
| A. | 该反应一定是放热反应 | B. | t4~t5阶段改变的条件为减小压强 | ||
| C. | B的起始物质的量为0.02mol | D. | 该反应的化学方程式为3A(g)+B(g)?2C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种黄绿色的有毒气体 | |
| B. | 灼热的铜丝在氯气中燃烧,生成棕黄色的烟 | |
| C. | 可以用排饱和食盐水法收集氯气 | |
| D. | 氯水、液氯是同一种物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com