
分析 (1)碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水;氢氧化镁与盐酸反应生成氯化镁和水;
(2)不能服用小苏打来治疗,因为反应产生的气体会造成胃部气胀,加重病情.
解答 解:(1)碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式为:NaHCO3+HCl=H2O+NaCl+CO2↑;
氢氧化镁与盐酸反应生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O,
故答案为:NaHCO3+HCl=H2O+NaCl+CO2↑;Mg(OH)2+2HCl═MgCl2+2H2O;
(2)如果病人同时患胃溃疡,为防止胃壁穿孔,不能服用小苏打来治疗,因为反应产生的气体会造成胃部气胀,加重病情,
故答案为:氢氧化镁;小苏打与胃酸反应产生二氧化碳气体易使胃壁穿孔.
点评 本题考查了化学方程式书写,题目难度中等,明确明确常见治疗胃酸药品的类型及特点为解答关键,注意掌握化学方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242KJ•mol-1(燃烧热) | |
| B. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114KJ•mol-1(中和热) | |
| C. | H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H=-286KJ•mol-1(反应热) | |
| D. | C(石墨,S)+$\frac{1}{2}$O2(g)═CO(g)△H=-111KJ•mol-1(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
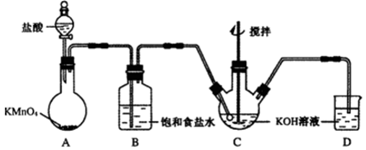
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
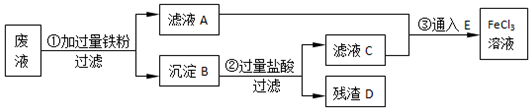
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com