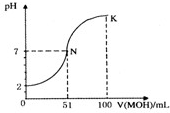
Ⅰ常温下,向100mL0.01mol?L
-1HA溶液中逐滴加入0.02mol?L
-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
(1)由图中信息可知HA为
强
强
酸(填“强”或“弱”),理由是
0.01mol/LHA的pH=2,说明HA完全电离
0.01mol/LHA的pH=2,说明HA完全电离
.
(2)N点对应溶液中离子浓度由大到的顺序为
c(A-)=c(M+)>c(H+)c(OH-)
c(A-)=c(M+)>c(H+)c(OH-)
.
(3)若K点所对应的溶液pH=10,则c(MOH)+c(OH
-)-c(H
+)=
0.005
0.005
mol?L
-1.
Ⅱ复分解反应存在这样一个规律:一种较强酸与一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH
3COOH+Na
2CO
3=2CH
3COONa+H
2O+CO
2↑
若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质.依照该规律回答下列问题:
(4)已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
| 溶质 |
CH3COONa |
NaHCO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
10.3 |
11.1 |
11.3 |
上述盐溶液中的阴离子,结合H
+能力最强的是
C6H5O-
C6H5O-
,
(5)下列反应不能成立的是
AD
AD
(填编号).
A.CO
2+H
2O+2NaClO=Na
2CO
3+2HClO
B.CO
2+H
2O+NaClO=NaHCO
3+HClO
C.CO
2+H
2O+C
6H
5ONa=NaHCO
3+C
6H
5OH
D.CO
2+H
2O+2C
6H
5ONa=Na
2CO
3+2C
6H
5OH
E.CH
3COOH+NaCN=CH
3COONa+HCN.




 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案 Ⅰ常温下,向100mL0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
Ⅰ常温下,向100mL0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题: