
当物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液中所含Cl﹣的个数相等时,这三种溶液的体积比应是()
A. 1:1:1 B. 1:2:3 C. 3:2:1 D. 6:3:2
考点: 物质的量浓度.
专题: 物质的量浓度和溶解度专题.
分析: 设NaCl、MgCl2、AlCl3三种溶液的体积分别为x、y和z,物质的量浓度为c,根据n=cV及NaCl、MgCl2、AlCl3的组成列式求算.
解答: 解:设NaCl、MgCl2、AlCl3三种溶液的物质的量浓度为c,体积分别为x、y、z;所含Cl﹣的个数相等,所以氯离子的物质的量相等,设氯离子的物质的量为m,
NaCl溶液中,c(NaCl)=c(Cl﹣),n(Cl﹣ )=cx=m,x=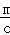 ,
,
MgCl2溶液中,c(MgCl2)=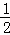 c(Cl﹣)=c,c(Cl﹣)=2c,n(Cl﹣ )=2cy=m,y=
c(Cl﹣)=c,c(Cl﹣)=2c,n(Cl﹣ )=2cy=m,y=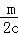 ,
,
AlCl3溶液中,c(AlCl3)=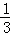 c(Cl﹣),c(Cl﹣)=3c,n(Cl﹣ )=3cz=m,z=
c(Cl﹣),c(Cl﹣)=3c,n(Cl﹣ )=3cz=m,z= ,
,
NaCl、MgCl2、AlCl3三种溶液的体积比应  :
: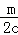 :
: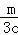 =6:3:2,
=6:3:2,
故选D.
点评: 本题考查了物质的量浓度,题目难度不大,主要涉及了物质的量浓度、溶液体积、溶质的物质的量三者的换算,以及溶质的物质的量浓度与其电离后离子浓度的关系.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是()
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是 ( )。
A.加热法只可软化暂时硬度的硬水
B.海水淡化的主要方法有蒸馏法和电渗析法等
C.反应2NaR+Ca2+===CaR2+2Na+的逆反应在一定条件下也能发生
D.硬水软化就是除净水中的Ca2+和Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是()
A. 溶液中有晶体析出,Na+数目不变
B. 溶液中有气体逸出,Na+数目增加
C. 溶质的质量分数增大
D. 溶液中Na+数目减少,溶质质量分数未变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. Fe、Cu、Al在空气中都容易生锈是因为都生成了对应的氧化物
B. FeCl3、FeCl2和Fe(OH)3都可以通过化合反应得到
C. 高温时,CuO比Cu2O稳定,Na2O2比Na2O稳定
D. Si02不溶于水,不是酸性氧化物,但能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. CaCl2在熔融状态下可导电,它是强电解质
B. 没有单质参加的化合反应一定是非氧化还原反应
C. 元素处于最高价态时一定具有强氧化性
D. 在2KClO3+4HCl(浓)═2KCl+2ClO2+Cl2+2H2O中,氯气既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶澄清的溶液,可能含NH4+、K+、Na +、Mg2+、Ba2+、Al3+、Fe3+、SO42﹣、CO32﹣、Cl﹣、I﹣中的一种或几种,取该溶液进行如下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,CCl4层呈紫红色;
(3)取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
(4)取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
根据上述实验事实确定并回答:在溶液中肯定存在的离子有 ,肯定不存在的离子有 ,还不能确定是否存在的离子有 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com