
| A、混合溶液中:c(HB)+c(B-)=0.05mol/L |
| B、混合溶液中:c(OH-)+c(B-)-c(H+)=0.04mol/L |
| C、该NaB溶液中:c(H+)+c(HB)=1.0×10-6mol/L |
| D、该NaB溶液中:c(Na+)-c(B-)=9.9×10-7mol/L |
| 1 |
| 2 |
| 1 |
| 2 |
| 1×10-14 |
| 1×10-8 |


科目:高中化学 来源: 题型:
| A、Ni:[Ar]3d8 |
| B、Cu:[Ar]3d94s2 |
| C、S2-:[Ne]2s23p6 |
| D、Si:[Ne]3s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中的乙酸,可以用饱和的碳酸钠溶液 |
| B、配制溶液时,俯视刻度线来定容,会使得所配溶液浓度偏高 |
| C、用托盘天平称取8.7克食盐 |
| D、实验室可以用新制氢氧化铜悬浊液来检验甘油,观察到的现象是出现绛蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
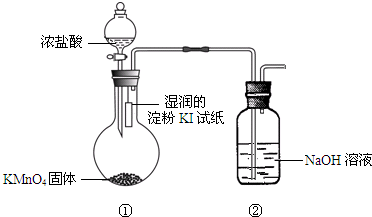 欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).
欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、将该溶液加水稀释,
| ||
| B、加入少量KOH固体,钠离子和碳酸根离子浓度均增大 | ||
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | ||
| D、c(Na+)=c(HCO3- )+2c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com