
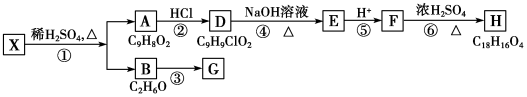
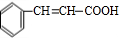 ,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
,检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.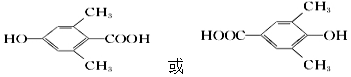 .
.分析 天然食用香料X是芳香族化合物,说明X中含有苯环;G的产量是衡量一个国家石油化工发展水平的标志,则G是CH2=CH2,B能反应生成C结合B分子式知,B为CH3CH2OH,该反应为消去反应;
X发生水解反应生成A和乙醇,则A为羧酸,根据分子式知,A中含有一个-COOH,A的不饱和度=$\frac{9×2+2-8}{2}$=6,苯环的不饱和度是4、碳氧双键的不饱和度是1,说明A中还含有一个碳碳双键,A的核磁共振氢谱有6个吸收峰,则A结构简式为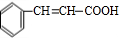 ,则X结构简式为
,则X结构简式为 ;A发生加成反应生成D,D发生水解反应生成E,E酸化得到F,F发生自身酯化反应生成H,H为酯类物质,结构中除苯环外还含有一个六元环,说明F分子中羧基、羟基连接同一碳原子上,故D为
;A发生加成反应生成D,D发生水解反应生成E,E酸化得到F,F发生自身酯化反应生成H,H为酯类物质,结构中除苯环外还含有一个六元环,说明F分子中羧基、羟基连接同一碳原子上,故D为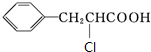 ,E为
,E为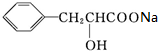 ,F为
,F为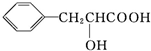 ,H为
,H为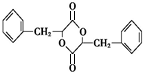 ;
;
(4)乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成乙二醇,乙二醇发生催化氧化反应生成乙二醛,乙二醛发生催化氧化反应生成乙二酸.
解答 解:天然食用香料X是芳香族化合物,说明X中含有苯环;G的产量是衡量一个国家石油化工发展水平的标志,则G是CH2=CH2,B能反应生成C结合B分子式知,B为CH3CH2OH,该反应为消去反应;
X发生水解反应生成A和乙醇,则A为羧酸,根据分子式知,A中含有一个-COOH,A的不饱和度=$\frac{9×2+2-8}{2}$=6,苯环的不饱和度是4、碳氧双键的不饱和度是1,说明A中还含有一个碳碳双键,A的核磁共振氢谱有6个吸收峰,则A结构简式为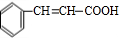 ,则X结构简式为
,则X结构简式为 ;A发生加成反应生成D,D发生水解反应生成E,E酸化得到F,F发生自身酯化反应生成H,H为酯类物质,结构中除苯环外还含有一个六元环,说明F分子中羧基、羟基连接同一碳原子上,故D为
;A发生加成反应生成D,D发生水解反应生成E,E酸化得到F,F发生自身酯化反应生成H,H为酯类物质,结构中除苯环外还含有一个六元环,说明F分子中羧基、羟基连接同一碳原子上,故D为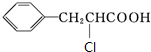 ,E为
,E为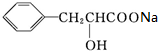 ,F为
,F为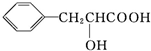 ,H为
,H为 ;
;
(1)通过以上分析知,A的结构简式为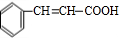 ,A中非含氧官能团为碳碳双键,碳碳双键能和溴发生加成反应而使溴水或溴的四氯化碳溶液褪色,所以检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液,
,A中非含氧官能团为碳碳双键,碳碳双键能和溴发生加成反应而使溴水或溴的四氯化碳溶液褪色,所以检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液,
故答案为: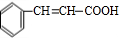 ;溴水或溴的四氯化碳溶液;
;溴水或溴的四氯化碳溶液;
(2)②的反应类型为加成反应,反应③为乙醇的消去反应,所以该反应的化学方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O,
故答案为:加成反应;CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O;
(3)F为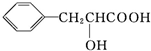 ,F中所含官能团的名称为羟基和羧基;
,F中所含官能团的名称为羟基和羧基;
其同分异构体中,遇FeCl3溶液发生显色反应,说明含有酚羟基;
且能与碳酸氢钠溶液反应,说明含有羧基,其苯环上一氯代物只有一种,
说明其苯环上有4个取代基,且两个甲基取代基位于酚羟基或羧基的中间,羧基和酚羟基位于对位,
所以符合条件的有2种同分异构体,
其中一种结构简式: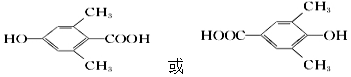 ,
,
故答案为:羧基和羟基;2;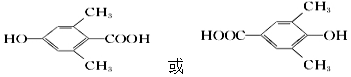 ;
;
(4)乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成乙二醇,乙二醇发生催化氧化反应生成乙二醛,乙二醛发生催化氧化反应生成乙二酸,其合成路线为CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$→_{△}^{NaOH/H_{2}O}$HOCH2CH2OH$→_{△}^{Cu}$OHCCHO$→_{△}^{催化剂}$HOOCCOOH,
故答案为:CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$→_{△}^{NaOH/H_{2}O}$HOCH2CH2OH$→_{△}^{Cu}$OHCCHO$→_{△}^{催化剂}$HOOCCOOH.
点评 本题考查有机物推断和有机合成,为高频考点,结合反应条件采取正逆推法相同结构进行推断,熟练掌握官能团的性质与转化是解本题关键,难点是合成路线设计,题目难度中等.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 移走少量C | B. | 扩大容积,减小压强 | ||
| C. | 缩小容积,增大压强 | D. | 容积不变,充入“惰”气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe (OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加人H2O2后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | 将少量溴水加入KI溶液中,充分反应后再加入CCl4,振荡,静置,下层液体呈紫色 | 氧化性:Br2>I2 |
| B | 常温下,打磨后的铝片放入HNO3中,无明显现象 | 常温下,铝不与浓HNO3反应 |
| C | 向一定量AgNO3溶液中,先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 用pH计测定NaF溶液和CH3COONa溶液可知:pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅太阳能电池利用的是原电池原理 | |
| B. | 用干燥的钢瓶盛装液氯和用铁制容器盛装容器盛装浓硝酸的原理相同 | |
| C. | 含有活性炭的口罩可阻挡雾霾,其原理是利用活性炭的吸附作用 | |
| D. | 用菜籽油浸泡花椒制得花椒油后,用分液的方法将花椒油分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
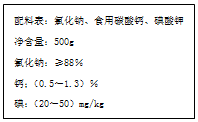 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
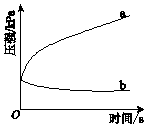 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )| A. | 两容器中负极反应均为Fe-2e-═Fe2+ | |
| B. | 曲线a记录的是pH=2的盐酸中压强的变化 | |
| C. | 曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH- | |
| D. | 在弱酸性溶液中,生铁能发生吸氧腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com