
分析 (1)根据配制一定物质的量浓度的溶液的配制步骤选择使用的仪器;
(2)依据容量瓶构造及正确使用方法解答;
(3)依据浓硫酸稀释的正确操作解答;
(4)分析操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使n偏小或者使V偏大的操作都能够使溶液浓度偏低,反之使溶液浓度偏高,据此解答.
解答 解:(1)配制一定物质的量浓度的溶液的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,使用的仪器顺序为:10mL量筒、50mL烧杯、玻璃棒、100mL容量瓶、胶头滴管;
故答案为:EGCHF;
(2)A.在容量瓶的使用方法中,A.使用容量瓶前应该检验是否漏水,故A正确;
B.容量瓶用水洗净后,不能用待配溶液洗涤,否则会影响配制溶液的浓度,故B错误;
C.容量瓶为精密仪器,不能在容量瓶中溶解固体,故C错误;
D.容量瓶为精密仪器,不能在容量瓶中稀释浓溶液,故C错误;
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确;
故选:BCD;
(3)稀释浓硫酸正确的操作为:将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌;
故答案为:将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌;
(4)①未经冷却趁热将溶液注入容量瓶中,冷却后,液面下降,溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
②容量瓶中原有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变;
故答案为:不变;
③定容时观察液面仰视,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低.
点评 本题考查一定物质的量浓度溶液的稀释,熟悉配制原理、注意容量瓶、量筒规格的选取方法,并明确浓硫酸的稀释方法,题目难度不大.


科目:高中化学 来源: 题型:填空题
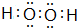 该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”)
该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: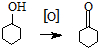
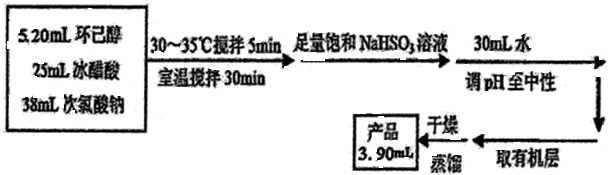
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
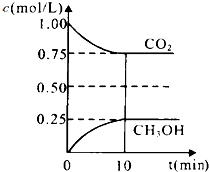 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 某溶液中加入氯化钡溶液,产生白色沉淀,再加入稀硝酸沉淀不溶解 | 溶液中一定含有SO42- |
| B | 某溶液中加入硝酸银溶液,产生白色沉淀 | 溶液中一定含有Cl- |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无K+ |
| D | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是淡黄色固体 | |
| B. | 钠的密度:小于煤油大于水 | |
| C. | 钠在化学反应中只能做还原剂 | |
| D. | 钠与硫酸铜溶液反应有红色的铜生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 细铁丝在氧气里点燃后剧烈燃烧,火星四射,产生黑色固体 | |
| B. | 氢气燃烧产生淡蓝色火焰 | |
| C. | 硫在空气中燃烧产生明亮的蓝紫色火焰,并生成有刺激性气味的气体 | |
| D. | 红磷在空气中燃烧产生大量白烟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com