

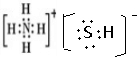 ,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫氢键的作用力.
,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫氢键的作用力.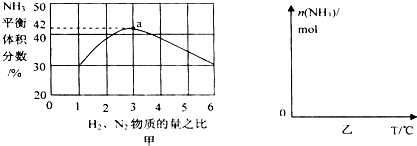
分析 (1)NH4HS的电子式是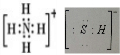 ;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;NH3分子间存在氢键,所以NH3的沸点高于H2S;
;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;NH3分子间存在氢键,所以NH3的沸点高于H2S;
(2)硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10-2,非常的大,所以硫酸氢铵溶液的酸性强同浓度的氯化铵;
(3)依据反应特征N2+3H2=2NH3,反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为 100,氨气为体积42,计算反应的氮气,依据气体体积比计算原混合气体中氮气体积,得到平衡状态下氮气体积分数;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,据此画出变化图象;
(5)依据反应是气体体积减小的放热反应,结合平衡移动原理分析判断.
解答 解:(1)NH4HS的电子式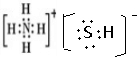 ;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;
;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;
;NH3分子间存在氢键,所以NH3的沸点高于H2S,
故答案为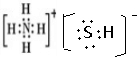 ;2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S; 氢键;
;2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S; 氢键;
(2)硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10-2,非常的大,而氯化铵是水解呈酸性,所以硫酸氢铵溶液的酸性强同浓度的氯化铵,
故答案为:硫酸氢铵;硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10-2,非常的大,大于铵根离子水解产生的酸性;
(3)依据反应特征列式计算,
N2+3H2=2NH3 △V
1 3 2 2
平衡体积 V V
即反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142×$\frac{1}{4}$=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5-21=14.5,则氮气体积分数为14.5%;
故答案为:14.5%;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,画出的图象为: ,故答案为:
,故答案为: ;
;
(5)分析流程合成氨放热通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理分析,加压、分离出氨气促进平衡正向进行、把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率;
故答案为:Ⅳ;分离液氨,未反应的氮气和氢气循环使用.
点评 本题考查了化学平衡影响因素分析,平衡计算应用,注意反应特征的计算应用,图象绘制,掌握基础是关键,题目难度较大.


科目:高中化学 来源: 题型:解答题
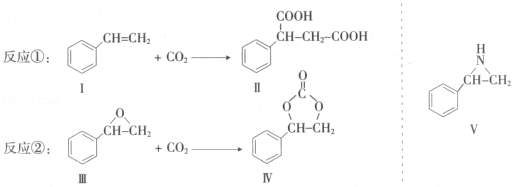
 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为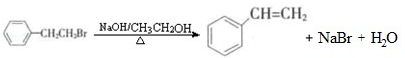 (注明反应条件).
(注明反应条件).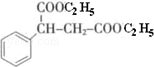 .
.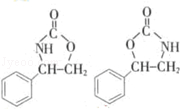 .
.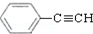 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有AB(双选,填字母).
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有AB(双选,填字母).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、Cl-、NO3-等离子能在甲基橙试液显红色的溶液中共存 | |
| B. | K+、Mg2+、Cl-、I-等离子能在[H+]=10-12 mol•L-1的溶液中共存 | |
| C. | NaHS水解的离子方程式为:HS-+H2O?S2-+H3O+ | |
| D. | NaHCO3的电离方程式为:NaHCO3=Na++HCO3-,HCO3-?H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li为电池的负极 | |
| B. | 充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 | |
| C. | 电池的电解液可用LiCl水溶液代替 | |
| D. | 放电时电子从负极经外电路流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B在元素周期表的位置第二周期IVA族;
,B在元素周期表的位置第二周期IVA族; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com