
【题目】将0.2mol两种气态烃组成的混合气体,完全燃烧后得到6.72L二氧化碳(标准状况下)和7.2g水,下列说法正确的是( )
A.一定有乙烯烯B.一定有甲烷
C.一定没有甲烷D.一定没有乙烯
【答案】B
【解析】
根据![]() 计算7.2克水的物质的量,根据
计算7.2克水的物质的量,根据![]() 计算二氧化碳的物质的量,根据H原子、C原子守恒计算混合物的平均分子组成,据此判断:两种气态烃组成的混合物0.2mol完全燃烧得6.72L二氧化碳和7.2克水,7.2克水的物质的量为7.2g÷18g/mol=0.4mol,平均分子组成中H原子数目为:0.4mol×20.2mol=4,6.72L二氧化碳的物质的量=6.72L÷22.4L/mol=0.3mol,平均分子组成C原子数目为:0.3mol÷0.2mol=1.5,故该混合烃的平均分子式为C1.5H4,根据C原子可知,该烃一定含有CH4,根据H原子可知,另一烃的分子中H原子数目为4。
计算二氧化碳的物质的量,根据H原子、C原子守恒计算混合物的平均分子组成,据此判断:两种气态烃组成的混合物0.2mol完全燃烧得6.72L二氧化碳和7.2克水,7.2克水的物质的量为7.2g÷18g/mol=0.4mol,平均分子组成中H原子数目为:0.4mol×20.2mol=4,6.72L二氧化碳的物质的量=6.72L÷22.4L/mol=0.3mol,平均分子组成C原子数目为:0.3mol÷0.2mol=1.5,故该混合烃的平均分子式为C1.5H4,根据C原子可知,该烃一定含有CH4,根据H原子可知,另一烃的分子中H原子数目为4。
A.该混合烃的平均分子式为C1.5H4,可能有乙烯,故A错误;
B.该混合烃的平均分子式为C1.5H4,一定有甲烷CH4,故B正确;
C.一定有甲烷CH4,故C错误;
D.该混合烃的平均分子式为C1.5H4,可能有乙烯,故D错误;
答案选B。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】![]() 铜镁合金完全溶解于
铜镁合金完全溶解于![]() 、密度为
、密度为![]() 、质量分数为
、质量分数为![]() 的浓硝酸中,得到
的浓硝酸中,得到![]() 气体
气体![]() 标准状况
标准状况![]() ,向反应后的溶液中加入适量的
,向反应后的溶液中加入适量的![]() 溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是
溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是![]()
![]()
A.该浓硝酸中HNO3的物质的量浓度是14 mol/L
B.加入NaOH溶液的体积是160 mL
C.起氧化性的硝酸的物质的量为0.16 mol
D.得到的金属氢氧化物的沉淀为6.24 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。

已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为______。
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是_______(至少写两点)。
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为_______。一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_______。
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

计算C点时该反应的压强平衡常数Kp(C)= _______ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下电解法合成氨的原理如图所示。下列说法中错误的是( )
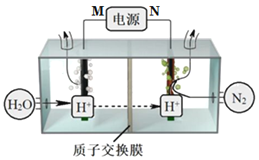
A.M为外接电源的正极
B.右室电极反应式为N2+6H++6e-=2NH3
C.理论上左、右室产生的气体同温同压下体积比为3︰4
D.该合成氨反应是化合反应、放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯的发生装置如图所示。下列说法正确的是

A.烧瓶中加入乙醇、浓硫酸和碎瓷片
B.反应温度控制在140℃
C.导出的气体中只有乙烯
D.可用向上排气法收集乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
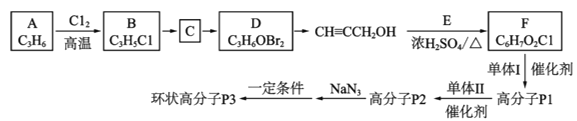
【题目】一种环状高分子P3的合成路线如图:
已知:①P2的结构为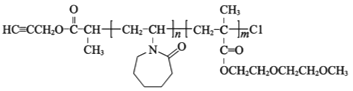
②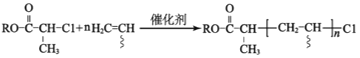 (
(![]() 表示取代基)
表示取代基)
③RCl![]() RN3
RN3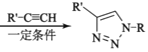
(1)A是一种常用的化工原料,其中包括的官能团是__。
(2)B→C的反应类型是__。
(3)D生成CH![]() CCH2OH的反应条件是__。
CCH2OH的反应条件是__。
(4)上述流程中生成F的反应为酯化反应,则该反应的化学方程式是__。
(5)单体II的结构简式是__。
(6)下列说法正确的是__(填字母)
a.F→P1的反应类型为缩聚反应
b.P3的结构如图所示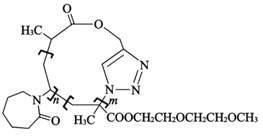
c.P2→P3的过程中可能得到线型高分子
d.碱性条件下,P3可能彻底水解成小分子物质
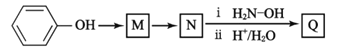
(7)已知: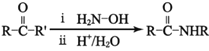 ;Q(C6H11NO)是用于合成单体I的中间体。如图是以苯酚为原料合成Q的流程,M→N的化学方程式是__。
;Q(C6H11NO)是用于合成单体I的中间体。如图是以苯酚为原料合成Q的流程,M→N的化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
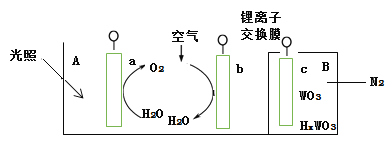
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅹ、Y、Z、W、M五种元素的原子序数依次增大。已知Ⅹ、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是
A. 原子半径:r(M)>r(Y)>r(Z)>r(W)>r(X)
B. W和M形成的化合物不能与强碱反应
C. Ⅹ、Z、W三元素所形成的化合物一定为共价化合物
D. Y、Z的最高价含氧酸的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知R-CH=CH2+HX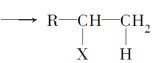 ,且CH3CH2OH
,且CH3CH2OH![]() CH2=CH2。A、B、C、D、E有如下转化关系:
CH2=CH2。A、B、C、D、E有如下转化关系:
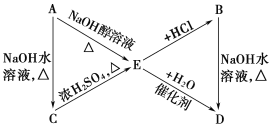
其中A、B是分子式均为C3H7Cl的两种同分异构体。根据图中各物质的转化关系,填写下列空白:
(1)A、B的结构简式:A________、B________。
(2)完成下列反应的化学方程式:
①A→E_____________________;
②B→D____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com