
【题目】锰及其化合物在生产、生活中有许多用途。在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和Al2O3等)制备金属锰等物质,设计流程如下:

己知:Mn2+有较强的还原性,在空气中能被氧气氧化,碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如下表。
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
(1)“酸浸”前需将软锰矿粉碎的目的是_____________;酸浸过程MnO2发生反应的离子方程式为_________________。
(2)向滤液I中需先加A物质,再加B物质,若加入的物质均为非金属化合物的溶液,则A为(填物质的名称)_________,B为(填物质的名称)________。滤渣II的成分是_______(填物质的化学式)。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度等,其中浸取率随酸浸时间的变化如图所示:

当浸取时间超过4h时,锰浸取率反而减小,其原因是______________。
(4)测得滤液I中c(Mn2+)=0.1mo/L,则加入B调节溶液pH范围为______。(已知:当某种离子浓度小于1×10-5mo/L时,可认为其沉淀完全。结果保留两位小数)
(5)“沉锰”过程中加入氨水的目的是(从化学平衡移动的角度解释)______________。
(6)写出由MnCO3为原料制备金属锰的过程中所涉及的化学方程式:____________。
【答案】 增大反应物接触面积,加快反应速率,提高原料利用率 MnO2+2Fe2++4H+ ![]() Mn2++2Fe3++2H2O 双氧水(或过氧化氢) 氨水 Fe(OH)3、 Al(OH)3 Mn2+被空气中的氧气氧化,从而使浸取率降低 4.67≤pH<8.00(或 4.67<pH<8.00) Mn2++HCO3-
Mn2++2Fe3++2H2O 双氧水(或过氧化氢) 氨水 Fe(OH)3、 Al(OH)3 Mn2+被空气中的氧气氧化,从而使浸取率降低 4.67≤pH<8.00(或 4.67<pH<8.00) Mn2++HCO3-![]() MnCO3+H+,氨水消耗了 H+, 促进反应平衡正向移动,有利于MnCO3的生成 4MnCO3+ O2
MnCO3+H+,氨水消耗了 H+, 促进反应平衡正向移动,有利于MnCO3的生成 4MnCO3+ O2![]() 2Mn2O3 + 4CO2 Mn2O3+2Al
2Mn2O3 + 4CO2 Mn2O3+2Al![]() Al2O3 + 2Mn
Al2O3 + 2Mn
【解析】考查化学工艺流程,(1)粉碎的目的是增大反应物的接触面积,加快反应速率,提高原料的利用率;根据流程,酸浸加入FeSO4,Fe2+具有还原性,MnO2具有强氧化性,因此发生的反应的有MnO2+2Fe2++4H+![]() Mn2++2Fe3++2H2O;(2)根据流程图,酸浸加入FeSO4是过量,以及物质的Ksp,因此先把Fe2+氧化成Fe3+,因此A和B均为非金属化合物的溶液,因此A为H2O2,名称为过氧化氢,然后调节pH,让Al3+、Fe3+转化成沉淀,因此B为NH3·H2O,名称为氨水,滤渣II为Al(OH)3、Fe(OH)3;(3)根据信息,Mn2+具有较强的还原性,在空气中能被氧气氧化,因此超过4小时后,锰的浸取率减小的原因是Mn2+被空气中氧气氧化,从而使浸取率降低;(4)Fe3+全部沉淀时的溶液中c(OH-)=
Mn2++2Fe3++2H2O;(2)根据流程图,酸浸加入FeSO4是过量,以及物质的Ksp,因此先把Fe2+氧化成Fe3+,因此A和B均为非金属化合物的溶液,因此A为H2O2,名称为过氧化氢,然后调节pH,让Al3+、Fe3+转化成沉淀,因此B为NH3·H2O,名称为氨水,滤渣II为Al(OH)3、Fe(OH)3;(3)根据信息,Mn2+具有较强的还原性,在空气中能被氧气氧化,因此超过4小时后,锰的浸取率减小的原因是Mn2+被空气中氧气氧化,从而使浸取率降低;(4)Fe3+全部沉淀时的溶液中c(OH-)=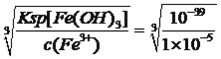 =10-11.3mol·L-1,则c(H+)=10-2.7mol·L-1,即pH=2.7,Al3+全部转化成沉淀时,溶液中c(OH-)=
=10-11.3mol·L-1,则c(H+)=10-2.7mol·L-1,即pH=2.7,Al3+全部转化成沉淀时,溶液中c(OH-)=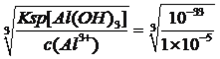 =10-9.33mol·L-1,则c(H+)=10-4.67mol·L-1,即pH=4.67,Mn2+开始出现沉淀时,c(OH-)=
=10-9.33mol·L-1,则c(H+)=10-4.67mol·L-1,即pH=4.67,Mn2+开始出现沉淀时,c(OH-)=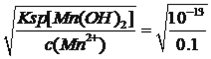 =10-6mol·L-1,则pH=8.0,因此加入NH3·H2O调节pH的范围是4.67≤pH<8.00(或 4.67<pH<8.00);(5)根据流程图,沉锰中Mn2+转化成MnCO3,因此发生的反应是Mn2++HCO3-
=10-6mol·L-1,则pH=8.0,因此加入NH3·H2O调节pH的范围是4.67≤pH<8.00(或 4.67<pH<8.00);(5)根据流程图,沉锰中Mn2+转化成MnCO3,因此发生的反应是Mn2++HCO3-![]() MnCO3+H+,加入氨水,消耗H+,平衡向正反应方向生成,有利于MnCO3生成;(6)根据信息,MnCO3在空气中高温加热固体产物为Mn2O3,化学反应方程式为4MnCO3+O2
MnCO3+H+,加入氨水,消耗H+,平衡向正反应方向生成,有利于MnCO3生成;(6)根据信息,MnCO3在空气中高温加热固体产物为Mn2O3,化学反应方程式为4MnCO3+O2![]() 2Mn2O3+4CO2,得到金属锰,常用Al作还原剂,发生的反应是Mn2O3+2Al
2Mn2O3+4CO2,得到金属锰,常用Al作还原剂,发生的反应是Mn2O3+2Al![]() Al2O3 + 2Mn。
Al2O3 + 2Mn。


科目:高中化学 来源: 题型:
【题目】我国双氧水(蒽醌法)生产厂家每年都会排放一定量的废镍触媒(主要含有金属镍,还含有Fe、Ca、Mg等杂质)。以其为原料制备NiSO4的工艺流程如下:
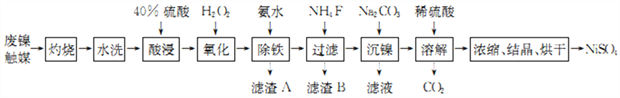
回答下列问题:
(1)废镍触媒灼烧的目的是___________________________。
(2)“酸浸”时,提高镍的浸取率的措施有_________(填字母)。
a.金属镍废料进行“粉碎” b.用硫酸多次浸取
c.浸取时间缩短一半 d.适当升高温度
(3)“氧化”时发生反应的n(Fe2+) ∶n( H2O2) =_________,滤渣B的主要成分的化学式为_________。
(4)已知溶液中c(Fe3+)≤1.0×10-5 mol·L-1 即除铁完全,Ksp[Fe(OH)3]=1×10-39。利用氨水调节溶液pH 可以将铁除去。若测得溶液的pH=3.5,则溶液中的铁是否完全除去? _______________________(列式计算)。
(5)“溶解”过程中反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸的组成用H2C2O4表示,为了测定某草酸溶液的浓度,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amolL﹣1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.
试回答:
(1)实验中,标准液KMnO4溶液应装在_____式滴定管中,因为______________.
(2)实验中眼睛注视_____________________,直至滴定终点.判断到达终点的现象是_________.
(3)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A. 滴定前仰视刻度,滴定后俯视刻度_________.
B. 锥形瓶在盛放待测液前未干燥,有少量蒸馏水_________.
C. 滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol NaOH的溶液恰好完全反应;另取一份加入含b moI HC1的溶液恰好不再放出气体。则该混合溶液中c(Na+)为 ( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现宇宙深处存在一行星,经实验测试知该行星大气中存在大量的H2C=CHOH物质。已知H2C=CHOH并不稳定,在常温下为液体,很容易转化成稳定的CH3CHO,该星球的温度是
A. 较低 B. 较高
C. 无法判断温度的高低 D. 以上说法均不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校同学在实验室中对一氧化碳与硫酸钙反应进行了探究。回答下列问题:
(1)甲组同学利用CaSO4·2H2O在400--500℃脱水制取无水CaSO4。实验中需用到的加热装置中的硅酸盐质的仪器除玻璃棒外,还用到______________。
(2)乙组同学利用H2C2O4·2H2O在浓硫酸作用下脱水生成CO、CO2并制备纯净的CO气体,实验装置如下:
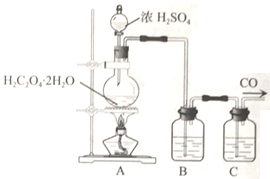
B、C中盛放的试剂依次为______、____________。
(3)丙组同学利用甲组制得的无水CaSO4和乙组制得的CO并利用下列装置验证反应并检验气态产物中有SO2和CO2产生。
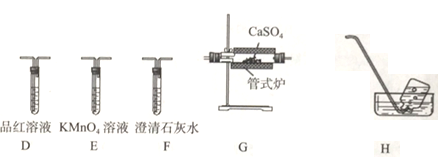
①上述装置(部分装置可重复使用)的连接顺序为C→___________。
②若E溶液褪色,则发生反应的离子方程式为_____________。
③能证明有CO2的生成的实验依据是____________。
④若G中产物为CaO,则G中发生反应的化学方程式为_________________。
(4)丁组的同学取丙组实验后G装置中的固体产物加入试管中,然后加人足量稀盐酸,固体完全溶液且产生少量气体,通入CuSO4溶液有黑色沉淀。可验证CO与CaSO4在高温下还发生了一个副反应,该反应为______________(用方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)既可以作氧化剂又可以作还原剂,当它在反应中作氧化剂时,可能生成的产物是( )
A.N2B.N2O3C.HNO3D.NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com