
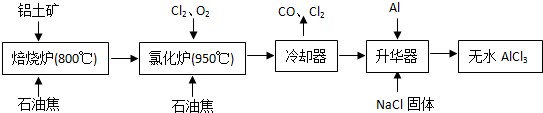
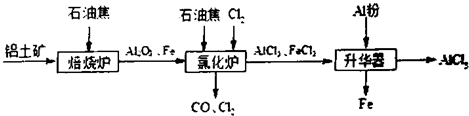
№ӨТөЙПУЙВБНБҝуЈЁЦчТӘіЙ·ЦКЗAl2O3әНFe2O3Ј©әНҪ№МҝЦЖұёОЮЛ®AlCl3өДБчіМИзПВ

ТСЦӘЈәAlCl3Ј¬FeCl3Ј¬·ЦұрФЪ183ЎжЎў315ЎжЙэ»Ә
ЈЁ1Ј©ФЪұәЙХВҜЦР·ўЙъ·ҙУҰЈә
ўЩFe2O3(s)Ј«3C(s)  2Fe(s)Ј«3CO(g) ЎчHЈҪЈӯ492.7kJ/mol
2Fe(s)Ј«3CO(g) ЎчHЈҪЈӯ492.7kJ/mol
ўЪ3CO(g)+ Fe2O3(s)  2Fe(s)Ј«3CO2(g) ЎчHЈҪЈ«25.2kJ/mol
2Fe(s)Ј«3CO2(g) ЎчHЈҪЈ«25.2kJ/mol
·ҙУҰ2Fe2O3(s)Ј«3C(s)
 4Fe(s)Ј«3CO2(g) ЎчHЈҪ___________kJ/molЎЈ
4Fe(s)Ј«3CO2(g) ЎчHЈҪ___________kJ/molЎЈ
ЈЁ2Ј©ўЩAl2O3Ј¬Cl2әНCФЪВИ»ҜВҜЦРёЯОВПВ·ўЙъ·ҙУҰЈ¬өұЙъіЙ1molAlCl3ЎЈКұЧӘТЖ______molөзЧУЈ»ВҜЖшЦРә¬УРҙуБҝCOәНЙЩБҝCl2Ј¬ҝЙУГNa2SO3ИЬТәіэИҘCl2Ј¬ЖдАлЧУ·ҪіМКҪОӘЈә____________________________ЎЈФЪОВ¶ИФјОӘ700ЎжПтЙэ»ӘЖчЦРјУИлВБ·ЫЈ¬·ўЙъ·ҙУҰөД»ҜС§·ҪіМКҪОӘ_______________ЎЈід·Ц·ҙУҰәуОВ¶ИҪөЦБ____________ТФПВЈЁМоЎ°183ЎжЎў315ЎжЦ®Т»Ј©Ј¬ҝӘКј·ЦАлКХјҜAlCl3ЎЈ
ўЪҪ«AlCl3ЎӨ 6H2OИЬУЪЕЁБтЛбҪшРРХфБуЈ¬ТІДЬөГөҪТ»¶ЁБҝөДОЮЛ®AlCl3Ј¬ҙЛФӯАнКЗАыУГЕЁБтЛбПВБРРФЦКЦРөД____ЈЁМоЧЦДёРтәЕЈ©ЎЈ
ўЩСх»ҜРФ ўЪОьЛ®РФ ўЫДС»У·ўРФ ўЬНСЛ®РФ
aЈ®Ц»УРўЩ b.Ц»УРўЪ cЈ®Ц»УРўЪўЫ d.Ц»УРўЪўЫўЬ
ЈЁ3Ј©әЈСуөЖЛюөзіШКЗАыУГВБЎўКҜД«ОӘөзј«ІДБПЈ¬әЈЛ®ОӘөзҪвЦКИЬТәЈ¬№№іЙөзіШөДЖдХэј«·ҙУҰКҪ ________Ј»УлЗҰРоөзіШПаұИЈ®КН·ЕПаН¬өзБҝКұЈ¬ЛщПыәДҪрКфөзј«ІДБПөДЦКБҝұИm(Al):m(Pb)ЈҪ_________________ЎЈ
ЈЁ№І14·ЦЈ©ЈЁ1Ј©ЈЁ1·ЦЈ©ЎӘ467.5 ЈЁ2Ј©ўЩ3ЈЁ2·ЦЈ©Ј»Cl2+SO32-+H2OЈҪ2Cl-+SO42-+2H+ (2·Ц)Ј»
Al+FeCl3ЈҪFe+AlCl3 (2·Ц)Ј»315ЎжЈЁ1·ЦЈ© ўЪ c (2·Ц)
ЈЁ3Ј©ЈЁ4·ЦЈ©O2+4e-+2H2OЈҪ4OH- ЈЁ2·ЦЈ©Ј» 2:23ЈЁ2·ЦЈ©
ЎҫҪвОцЎҝ
КФМв·ЦОцЈәЈЁ1Ј©ТСЦӘЈәўЩFe2O3(s)Ј«3C(s)  2Fe(s)Ј«3CO(g) ЎчHЈҪЈӯ492.7kJ/molәНўЪ3CO(g)+ Fe2O3(s)
2Fe(s)Ј«3CO(g) ЎчHЈҪЈӯ492.7kJ/molәНўЪ3CO(g)+ Fe2O3(s)  2Fe(s)Ј«3CO2(g) ЎчHЈҪЈ«25.2kJ/molЈ¬ЛщТФУЙёЗЛ№¶ЁВЙҝЙЦӘЈ¬ўЩЈ«ўЪјҙөГөҪ2Fe2O3(s)Ј«3C(s)
2Fe(s)Ј«3CO2(g) ЎчHЈҪЈ«25.2kJ/molЈ¬ЛщТФУЙёЗЛ№¶ЁВЙҝЙЦӘЈ¬ўЩЈ«ўЪјҙөГөҪ2Fe2O3(s)Ј«3C(s)
 4Fe(s)Ј«3CO2(g)Ј¬ЛщТФёГ·ҙУҰөД·ҙУҰИИЎчHЈҪЈӯ492.7kJ/molЈ«25.2kJ/molЈҪЈӯ467.5kJ/molЎЈ
4Fe(s)Ј«3CO2(g)Ј¬ЛщТФёГ·ҙУҰөД·ҙУҰИИЎчHЈҪЈӯ492.7kJ/molЈ«25.2kJ/molЈҪЈӯ467.5kJ/molЎЈ
ЈЁ2Ј©ўЩёщҫЭ№ӨТХБчіМҝЙЦӘВИ»ҜВҜөДІъОпЈ¬ҫӯАдИҙЎўЙэ»ӘҝЙЦЖұёОЮЛ®AlCl3Ј¬ЛөГчВИ»ҜВҜөДІъОпЦРә¬УРA1C13Ј¬АдДэЖчОІЖшә¬УРCOЈ¬ЛщТФAl2O3ЎўC12әНC·ҙУҰЈ¬ЙъіЙA1C13әНCOЈ¬·ҙУҰөД»ҜС§·ҪіМКҪОӘA12O3Ј«3C12Ј«3C 2A1C13Ј«3COЎЈ·ҙУҰЦРВИФӘЛШ»ҜәПјЫУЙ0јЫҪөөНОӘЈӯ1јЫЈ¬ВИЖшКЗСх»ҜјБЈ¬№КЙъіЙ1mol AlCl3КұЧӘТЖөзЧУОӘ1molЎБ3ЈҪ3molЈ»Cl2УРЗҝСх»ҜРФЈ¬ДЬҪ«SO32-Сх»ҜОӘSO42-Ј¬ЧФЙнұ»»№ФӯОӘC1-Ј¬ТтҙЛ·ҙУҰАлЧУ·ҪіМКҪОӘSO32-+C12+H2OЈҪSO42-+2C1-+2H+Ј»УЙ№ӨТХБчіМҝЙЦӘЈ¬Йэ»ӘЖчЦРЦчТӘә¬УРAlCl3әНFeCl3Ј¬јУИлЙЩБҝAlіэИҘFeCl3Ј¬AlУлFeCl3·ҙУҰЙъіЙFeЎўAlCl3Ј¬·ҙУҰөД»ҜС§·ҪіМКҪОӘAlЈ«FeCl3
2A1C13Ј«3COЎЈ·ҙУҰЦРВИФӘЛШ»ҜәПјЫУЙ0јЫҪөөНОӘЈӯ1јЫЈ¬ВИЖшКЗСх»ҜјБЈ¬№КЙъіЙ1mol AlCl3КұЧӘТЖөзЧУОӘ1molЎБ3ЈҪ3molЈ»Cl2УРЗҝСх»ҜРФЈ¬ДЬҪ«SO32-Сх»ҜОӘSO42-Ј¬ЧФЙнұ»»№ФӯОӘC1-Ј¬ТтҙЛ·ҙУҰАлЧУ·ҪіМКҪОӘSO32-+C12+H2OЈҪSO42-+2C1-+2H+Ј»УЙ№ӨТХБчіМҝЙЦӘЈ¬Йэ»ӘЖчЦРЦчТӘә¬УРAlCl3әНFeCl3Ј¬јУИлЙЩБҝAlіэИҘFeCl3Ј¬AlУлFeCl3·ҙУҰЙъіЙFeЎўAlCl3Ј¬·ҙУҰөД»ҜС§·ҪіМКҪОӘAlЈ«FeCl3 2A1C13Ј«FeЈ»УЙМвДҝРЕПўҝЙЦӘЈ¬AlCl3өДЙэ»ӘОВ¶ИёьөНЈ¬УҰҝШЦЖОВ¶ИК№AlCl3Йэ»ӘЈ¬ЗТFeCl3І»Йэ»ӘЈ¬ЛщТФОВ¶ИУҰҝШЦЖФЪ315ЎжТФПВЎЈ
2A1C13Ј«FeЈ»УЙМвДҝРЕПўҝЙЦӘЈ¬AlCl3өДЙэ»ӘОВ¶ИёьөНЈ¬УҰҝШЦЖОВ¶ИК№AlCl3Йэ»ӘЈ¬ЗТFeCl3І»Йэ»ӘЈ¬ЛщТФОВ¶ИУҰҝШЦЖФЪ315ЎжТФПВЎЈ
ўЪAlCl3Л®ҪвОьИИЈ¬ЦұҪУјУИИAlCl3•6H2OЈ¬Л®Ҫві№өЧЙъіЙЗвСх»ҜВБЈ¬өГІ»өҪВИ»ҜВБЎЈЕЁБтЛбОьЛ®Ј¬Н¬КұҝЙТФЙъіЙHClТЦЦЖВИ»ҜВБЛ®ҪвЈ¬АыУГЕЁБтЛбөДОьЛ®РФУлДС»У·ўРФЈ¬јҙҙр°ёСЎcЎЈ
ЈЁ3Ј©ФӯөзіШЦРҪП»оЖГөДҪрКфКЗёәј«Ј¬К§ИҘөзЧУЈ¬·ўЙъСх»Ҝ·ҙУҰЎЈөзЧУҫӯөјПЯҙ«өЭөҪХэј«Ј¬ЛщТФИЬТәЦРөДСфАлЧУПтХэј«ТЖ¶ҜЈ¬Хэј«өГөҪөзЧУЈ¬·ўЙъ»№Фӯ·ҙУҰЎЈТтҙЛёГФӯөзіШКөЦККЗҪрКфВБ·ўЙъөДОьСхёҜКҙЈ¬СхЖшФЪХэј«·ЕөзЙъіЙЗвСхёщАлЧУЈ¬өзј«·ҙУҰКҪОӘO2Ј«4e-Ј«2H2OЈҪ4OHЈӯЈ»өзБҝПаН¬Ј¬ФтФӯөзіШЧӘТЖөзЧУПаН¬ЎЈФЪ·ҙУҰЦРВБК§ИҘ3ёцөзЧУЈ¬ЗҰК§ИҘ2ёцөзЧУЎЈЙиЧӘТЖөзЧУОӘ3molЈ¬Фтn(Al)ЈҪ3molЎВ3ЈҪ1molЎўn(Pb)ЈҪ3molЎВ2ЈҪ1.5molЈ¬№Кm(Al):m(Pb)ЈҪ1molЎБ27g/mol:1.5molЎБ207g/mol=2:23ЎЈ
ҝјөгЈәҝјІй·ҙУҰИИөДјЖЛгЈ»Сх»Ҝ»№Фӯ·ҙУҰ·ҪіМКҪөДКйРҙТФј°УР№ШјЖЛгЈ»Л®ҪвЖҪәвЈ»өз»ҜС§ФӯАнөДУҰУГУлјЖЛгөИ


 ФД¶БҝміөПөБРҙр°ё
ФД¶БҝміөПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә

| јУИИ |
| јУИИ |
| јУИИ |
| ||
| ||
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
| ||
| ||
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә

| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
| ||
| ||
| ||
| ||
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә

| ||
| ||
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com