
| A. | 压缩容器体积,增大压强,活化分子百分数不变,化学反应速率增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率增大 | |
| C. | 加入反应物,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应所需的活化能,活化分子百分数增大,化学反应速率增大 |
分析 A.增大压强,活化分子数目增多;
B.升高温度,活化分子百分数增大;
C.加入反应物,浓度增大,活化分子数目增多;
D.催化剂,降低了反应所需的活化能,活化分子百分数增大.
解答 解:A.增大压强,活化分子数目增多,活化分子百分数不变,则化学反应速率增大,故A正确;
B.升高温度,活化分子百分数增大,则化学反应速率增大,故B正确;
C.加入反应物,浓度增大,活化分子数目增多,化学反应速率增大,故C错误;
D.催化剂,降低了反应所需的活化能,活化分子百分数增大,化学反应速率增大,故D正确;
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、催化剂对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意活化理论的理解,题目难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
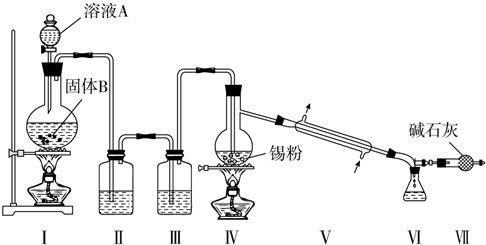
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
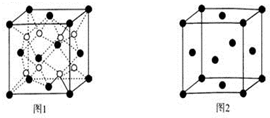
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
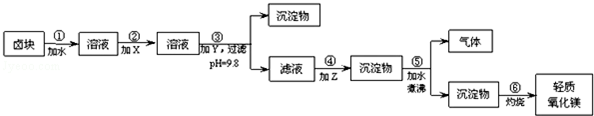
| 物质 | 价格/元•吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| B. | 红葡萄酒营养丰富(含葡萄糖、维生素C等),常添加微量的二氧化硫,利用二氧化硫还原性,防止红葡萄酒中某营养成分被氧化 | |
| C. | 某雨水放置一段时间后pH由4.68变为4.28,因为水中亚硫酸被空气中氧气氧化成硫酸 | |
| D. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是一个电化学过程示意图.
如图是一个电化学过程示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com