
【题目】下列措施不合理的是
A. 用SO2漂白纸浆和草帽辫
B. 用硫酸清洗锅炉中的水垢
C. 高温下用焦炭还原SiO2制取粗硅
D. 用Na2S作沉淀剂,除去废水中Cu2+和Hg2+
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g)cC(g)+dD(g),压缩容积到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如下:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL-1 H2C2O4 溶液 | 30 mL 0.01 molL-1 KMnO4 酸性溶液 |
② | 20 mL 0.2 molL-1 H2C2O4 溶液 | 30 mL 0.01 molL-1 KMnO4 酸性溶液 |

(1)检验上图装置气密性的最简便方法为:____________。
(2)H2C2O4溶液与酸性 KMnO4溶液反应的化学方程式为____________。
(3)该实验探究的是___________因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是___________(填实验序号)。
(4)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________(若忽略溶液混合前后体积的变化)。
(5)小组同学发现反应速率总是如上右图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①__________、②_________、③K+对该反应有催化作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3molA和2.5molB混合与2L密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
(1)x= 。
(2)平衡时C的浓度为多少?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a.实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+(滴定时,1mol (CH2)6N4H+与1mol H+相当),然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①选用滴定管为 (填“甲”或“乙”)。


②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”);锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010mo1· L-1,则该样品中氮的质量分数为 。
b .在测定中和热的实验中,下列说法正确的是( )
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5mol·L-1NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类 ( )
A. 75%的酒精溶液 B. 硝酸钠 C. Fe(OH)3胶体 D. 豆浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素aA、bB、cC、dD、eE的原子的结构示意图分别为
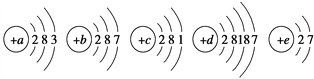
请回答下列问题:
(1)属于同周期的元素是__________(填元素符号,下同),属于同主族的元素__________。
(2)金属性最强的元素是__________,非金属性最强的元素是__________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是__________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等。甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示。


图1 图2
(1)①事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___________(填序号,下同)。
a.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0
b.2H2(g)+O2(g)=2H2O(l) ΔH<0
c.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
②甲同学设计的原电池,若将石墨棒改为铁片,则总电极反应式是否改变,若是,写出改变后总的电极反应式,若否,请写出理由:_______________________。
③乙同学设计的原电池电极反应与甲的相同,但电池的效率高很多。乙同学设计的原电池两电极分别为:a是_______(填“铜片”“铁片”或“石墨棒”,下同),b是__________。负极的电极反应式为___________________,正极的电极反应式为____________________。
(2)关于乙同学设计的原电池,下列说法中错误的是____________。
a.实验过程中,左侧烧杯中Cl浓度增大
b.实验过程中取出盐桥,原电池不能继续工作
c.电子通过盐桥从右侧烧杯进入左侧烧杯中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com