
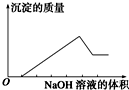
 某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-.向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )| A. | ①②⑤ | B. | ①③④ | C. | ②⑥⑦ | D. | ①②④⑥ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.2NA | |
| B. | 取50mL 14.0moI/L浓硝酸与足量的铜片反应,生成气体分子的数目为0.35NA | |
| C. | 标准状况下,2.24L二氧化硫中含有的电子总数为3.2NA | |
| D. | 40g金刚砂(SiC)中含有C-Si键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.| 实验 | pH | 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是指常温常压下,2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ | |
| B. | 是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出热量571.6 kJ | |
| C. | 是指标准状况下,2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ | |
| D. | 是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用浓硫酸干燥H2、NH3、Cl2等气体 | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 氨水、铵盐受热都易发生化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、C
、C .反应④所用试剂和条件是氢氧化钠醇溶液、加热.
.反应④所用试剂和条件是氢氧化钠醇溶液、加热. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com