
【题目】高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分。
(1)NaClO4溶液和NH4Cl溶液混合后发生复分解反应,有NH4ClO4固体析出,写出该反应的化学方程式:____。
(2)通过如下图所示的装置及实验步骤可以测定某高氯酸铵样品的纯度。

步骤1:检查装置气密性。
步骤2:准确称取样品0.2500 g于蒸馏烧瓶中,加入约150 mL水溶解。
步骤3:准确量取40.00 mL 0.1000 mol·L—1 H2SO4 溶液于锥形瓶中。
步骤4:经仪器A向蒸馏瓶中加入20 mL 3 mol·L—1NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用0.2000mol·L—1 NaOH标准溶液滴定至终点,消耗NaOH标准溶液30.00 mL。
步骤8:将实验步骤1~7重复2次。
①仪器A的名称是____。
②步骤1~7中,确保生成的氨被稀硫酸完全吸收的实验步骤是____(填步骤序号)。
③计算样品中高氯酸铵的质量分数____(写出计算过程,已知杂质不参与反应)。
【答案】NaClO4+NH4Cl=NH4ClO4↓+NaCl 分液漏斗 1、5、 6 n(NaOH)=0.2000 mol·L-1×30.00×10﹣3 L=0.006mol
由关系式“2 NaOH~H2SO4”可知,
过量的H2SO4的物质的量为:n(H2SO4)=![]() ×0.006mol=0.003 mol
×0.006mol=0.003 mol
与NH3反应的H2SO4的物质的量为:
n(H2SO4)=0.1000 mol·L-1×40.00×10﹣3 L-0.003 mol=0.001mol
由关系式“2 NH3~H2SO4”可知,
n(NH3)=2×0.001mol=0.002 mol
n(NH4ClO4)=n(NH3)=0.002 mol
m(NH4ClO4)=0.002 mol×117.5g·mol-1=0.235g
则样品中NH4ClO4的质量分数为:
ω(NH4ClO4)=0.235g÷0.2500 g×100%=94%
【解析】
(1)据信息,NaClO4溶液和NH4Cl溶液的复分解反应满足反应条件,反应物交换成分写出反应方程式;
(2). ①仪器A为分液漏斗;
②确保生成的氨被被硫酸完全吸收,气体不能泄漏,吸收剂要过量,不能在容器内残留;
③蒸馏烧瓶中NH4ClO4与NaOH溶液充分反应释放的NH3进入锥形瓶,在锥形瓶中被过量硫酸完全吸收,要计算样品中高氯酸铵的质量分数ω(NH4ClO4),需要计算纯高氯酸铵的质量m(NH4ClO4)、即要先计算n(NH4ClO4),因为n(NH4ClO4)=n(NH3),n(NH3)怎么算?H2SO4一部分用于吸收氨气,另一部分中和NaOH ,用于中和的那部分硫酸可通过滴定数据求得。
(1)NaClO4溶液和NH4Cl溶液的复分解反应有固体析出,化学方程式为NaClO4+NH4Cl=NH4ClO4↓+NaCl;
答案为:NaClO4+NH4Cl=NH4ClO4↓+NaCl;
(2). ①根据仪器A的构造,仪器A为分液漏斗,答案为:分液漏斗;
②确保生成的氨被硫酸完全吸收,应气密性好,尽可能完全反应,并冲洗冷凝管附着的氨水,所以为确保生成的氨被稀硫酸完全吸收的实验步骤为:1、5、6;
答案为:1、5、6;
③滴定消耗n(NaOH)=0.2000 mol·L-1×30.00×10﹣3 L=0.006mol
由关系式![]() 可知,
可知,
硫酸吸收氨气后过量的H2SO4的物质的量为:n(H2SO4)=![]() ×0.006mol=0.003 mol
×0.006mol=0.003 mol
与NH3反应的H2SO4的物质的量为:
n(H2SO4)=0.1000 mol·L-1×40.00×10﹣3 L-0.003 mol=0.001mol
由关系式![]() 可知,
可知,
n(NH3)=2×0.001mol=0.002 mol
n(NH4ClO4)=n(NH3)=0.002 mol
m(NH4ClO4)=0.002 mol×117.5g·mol-1=0.235g
则样品中NH4ClO4的质量分数为:
ω(NH4ClO4)=![]() =94%;
=94%;
答案为:94%。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。其中B是地壳中含量居第一的金属元素。请回答下列问题:

(1)写出金属B和气体丙的化学式______________、___________。
(2)写出反应①的化学反应方程式__________________________。
写出反应⑥的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列有关物质的用途、性质都正确且有相关性的是
选项 | 用途 | 性质 |
A | 液氨作制冷剂 | NH3分解生成N2和H2的反应是吸热反应 |
B | NH4Fe(SO4)2·12H2O常作净水剂 | NH4Fe(SO4)2·12H2O具有氧化性 |
C | 漂粉精可以作环境消毒剂 | 漂粉精溶液中ClO-和HClO都有强氧化性 |
D | Al2O3常作耐高温材料 | Al2O3,既能与强酸反应,又能与强碱反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
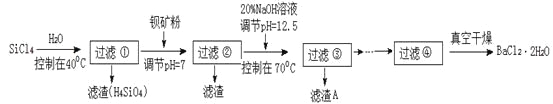
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解反应的化学方程式为_________________________________________________。过滤操作需要的玻璃仪器有_________________________________。
(2)加钡矿粉调节pH=7的作用是________________________、_______________________。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是_______________________。
(4)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(5)10吨含78.8 % BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_________吨。实际产量为9.70吨,相对误差为__________________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 X中可能含有如下离子:Na+、K+、![]() 、
、![]() 、
、![]() 、Cl-。取一定量该溶液,加入过量的BaCl2溶液,充分反应后过滤得固体Y和滤液Z。下列说法正确的是
、Cl-。取一定量该溶液,加入过量的BaCl2溶液,充分反应后过滤得固体Y和滤液Z。下列说法正确的是
A.取溶液X进行焰色反应,火焰呈黄色。说明溶液不含K+
B.取固体Y加入过量的稀盐酸,沉淀部分溶解。说明溶液X含![]() 、不含
、不含![]()
C.取滤液Z加入足量HNO3后再加入AgNO3溶液,有白色沉淀生成。说明溶液X中含Cl-
D.取滤液Z加入NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝。说明溶液X中含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铝粉和某铁的氧化物(xFeO·yFe2O3)粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是5 : 7,则x : y为
A.1∶1B.1∶2C.5∶7D.7∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有同学研究从矿石开始到产出钢铁的工艺流程。
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3。求该铁矿石含铁的质量分数。___________
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)___________
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况),计算此钢样粉末中铁和碳的物质的量之比。___________
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度___________
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用酚酞作指示剂,用 0.10mol·L-1NaOH 溶液分别滴定 20.00mL 浓度均为0.10mol·L-1的CH3COOH 溶液和 HCN 溶液所得滴定曲线如图。(已知电离平衡常数:CH3COOH> HCN)
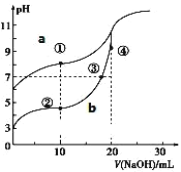
(1)图_____(a 或 b)是 NaOH 溶液滴定 HCN 溶液的 pH 变化的曲线。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:_____ 。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)_____c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)25 ℃时,用 0.1 mol·L-1的醋酸溶液滴定 20 mL 0.1 mol·L-1 的 NaOH 溶液,当滴加V mL 该醋酸溶液时, 混合溶液的 pH = 7 。已知醋酸的电离平衡常数为 Ka , 则Ka=________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连。则下列叙述不正确的是
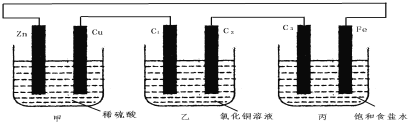
A.甲是化学能转变为电能,乙、丙是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、C3上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲中溶液的pH逐渐升高,乙、丙中溶液的pH逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com