

| A. | Zn极上发生还原反应 | |
| B. | 电子沿Zn→a→b→Cu路径流动 | |
| C. | 片刻后,乙池中c(Cu2+)减小,c(SO42-)基本不变,溶液不再保持电中性 | |
| D. | 片刻后可观察到滤纸a点变红色 |
分析 A.由图可知,K闭合时,甲、乙构成原电池,Zn为负极;
B.电子由负极流向正极,电子不能进入溶液中;
C.盐桥中离子可定向移动,中和电荷,溶液仍为电中性;
D.a与电源负极相连为阴极,溶液中氢离子在阴极放电.
解答 解:A.由图可知,K闭合时,甲、乙构成原电池,Zn为负极,失去电子发生氧化反应,故A错误;
B.电子由负极流向正极,电子不能进入溶液中,则电子沿Zn→a,b→Cu路径流动,故B错误;
C.盐桥中离子可定向移动,中和电荷,溶液仍为电中性,乙池中c(Cu2+)减小,c(SO42-)基本不变,故C错误;
D.a与电源负极相连为阴极,溶液中氢离子在阴极放电,则阴极区显碱性,遇酚酞溶液变红,故D正确;
故选D.
点评 本题考查原电池,为高频考点,把握电极、电极反应、电子的移动为解答关键,侧重分析与应用能力的考查,注意电解硫酸钠溶液实质为电解水,选项BC为易错点,题目难度不大.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 仪器及规格 |  100mL量筒 100mL量筒 |  250mL容量瓶 250mL容量瓶 |  托盘天平 托盘天平 |  锥形瓶 锥形瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 . G的一种合成路线如下:
. G的一种合成路线如下:


 ;X生成Y的反应类型是消去反应.
;X生成Y的反应类型是消去反应.
 .
.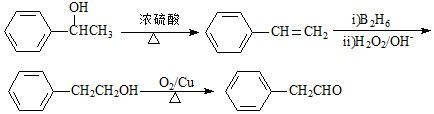 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84消毒液、高温等方法均可有效杀死H7N9禽流感病毒 | |
| B. | 地沟油不可食用,但可以和乙醇反应制备生物柴油 | |
| C. | 化石燃料燃烧产生大量的CO2是造成酸雨的主要原因,酸雨、温室效应和臭氧空洞是世界三大环境问题 | |
| D. | 目前使用的化石能源实际上是地球在远古时代为我们储存的太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中的相邻原子都以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 干冰升华时,分子内共价键会发生断裂 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子个数比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )
25℃时,向0.10mol•L-1 H2Y溶液中逐渐加入NaOH固体(忽略加入时引起的溶液体积变化),所得溶液中含Y元素的三种微粒的分布系数(浓度分数)δ随溶液pH变化的关系如图”所示,下列说法正确的是( )| A. | 曲线上任意一点均存在:c(H+)+c(Na+)═c(OH-)+c(Y2-)+c(HY-) | |
| B. | c(Na+)=0.10 mol•L-1时,溶液中的c(H+)+c(H2Y)═c(OH-)+c(Y2-) | |
| C. | 由图可知,H2Y为二元弱酸,如果将物质的量浓度均为0.20mol•L-1的NaHY和Na2Y溶液等体积混合,所得溶液的pH=4.2 | |
| D. | 已知25℃时,HCOOH的Ka=1×10-4.若把少量H2Y加入到HCOONa溶液中,发生的离子反应可表示为:H2Y+2HCOO-═2HCOOH+Y2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 最近世界各国都在研究“1C化学”、“2C化学”,它们是以1个或2个碳原子
最近世界各国都在研究“1C化学”、“2C化学”,它们是以1个或2个碳原子| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-3mol•L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com