
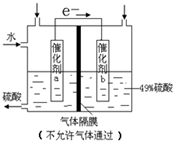
 如图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是
如图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是 O2 =H2SO4,先设加入的SO2的量和加入的水的量,再根据方程求出生成硫酸的量和消耗的水的量.
O2 =H2SO4,先设加入的SO2的量和加入的水的量,再根据方程求出生成硫酸的量和消耗的水的量. O2+2H++2e-=H2O
O2+2H++2e-=H2O O2=H2SO4
O2=H2SO4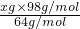

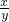 =
=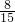 ,故D正确;
,故D正确;

 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.
查看答案和解析>>
科目:高中化学 来源: 题型:
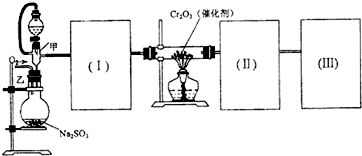
| Cl2O2 |
| 熔点(℃) | 沸点(℃) | |
| SO2 | -72.4 | -10 |
| SO3 | 16.8 | 44.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
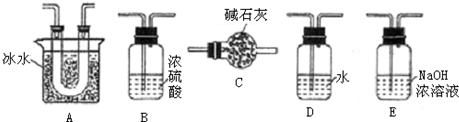
| 方法1 | 用氨水将SO2转化为(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法2 | 用活性炭吸附法处理SO2 |
| 方法3 | 用Na2SO4溶液吸收SO2,再进行电解得到S单质 |
| t(min) 浓度(mol?L-1) |
0min | 1min | 2min | 3min | 4min | 5min | 6min |
| c(SO2) | 0.054 | 0.034 | 0.018 | 0.010 | 0.008 | 0.006 | 0.006 |
| c(O2) | 0.032 | 0.022 | 0.014 | 0.010 | 0.009 | 0.008 | 0.008 |
| ||
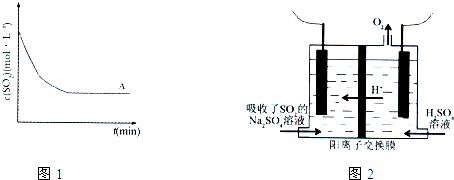
查看答案和解析>>
科目:高中化学 来源: 题型:
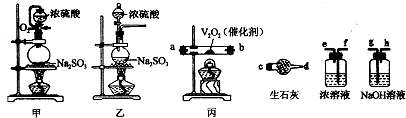
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com