
分析 取6.64g天然碱用酒精灯充分加热至恒重,将生成的气体依次通过过量的浓硫酸、过量澄清石灰水后,浓硫酸增重0.9g,澄清石灰水中生成沉淀1g,可知加热分解生成CO2、H2O,且m(H2O)=0.9g,m(CaCO3)=1g,则m(CO2)=$\frac{1g}{100g/mol}×44g/mol$=0.44g,
如天然碱全部为NaHCO3,则2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O,
168g 106g 44g 18g
1.68g 1.06g 0.44g 0.18g,
因加热后m(H2O)=0.9g>0.18g,剩余固体质量为6.64g-0.9g-0.44g=5.3g>1.06g,
可知天然碱中含有Na2CO3、NaHCO3、H2O,结合相关反应的化学方程式可确定各自的物质的量,进而可确定分子式,以此解答该题.
解答 解:(1)取6.64g天然碱用酒精灯充分加热至恒重,将生成的气体依次通过过量的浓硫酸、过量澄清石灰水后,浓硫酸增重0.9g,澄清石灰水中生成沉淀1g,可知加热分解生成CO2、H2O,且m(H2O)=0.9g,m(CaCO3)=1g,则m(CO2)=$\frac{1g}{100g/mol}×44g/mol$=0.44g,
则剩余固体质量为6.64g-0.9g-0.44g=5.3g,
故答案为:5.3;
(2)反应生成m(CO2)=$\frac{1g}{100g/mol}×44g/mol$=0.44g,
如天然碱全部为NaHCO3,则2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O,
168g 106g 44g 18g
1.68g 1.06g 0.44g 0.18g,
因加热后m(H2O)=0.9g>0.18g,剩余固体质量为6.64g-0.9g-0.44g=5.3g>1.06g,
可知天然碱中含有Na2CO3、NaHCO3、H2O,
故答案为:NaHCO3、H2O;
(3)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O,
68g 106g 44g 18g
1.68g 1.06g 0.44g 0.18g,
则6.64g天然碱中,含碳酸钠的质量为5.3g-1.06g=4.24g,
n(Na2CO3)=$\frac{4.24g}{106g/mol}$=0.04mol,
故答案为:0.04;
(4)由以上计算可知n(Na2CO3)=0.04mol;
n(NaHCO3)=2n(CO2)=0.02mol;
n(H2O)=$\frac{0.9g-0.18g}{18g/mol}$=0.04mol,
则n(Na2CO3):n(NaHCO3):n(H2O)=2:1:2,分子式为2Na2CO3•NaHCO3•2H2O,
故答案为:2Na2CO3•NaHCO3•2H2O.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从守恒的角度解答该题,难度不大.


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 | |
| B. | 甲烷、苯、乙酸乙酯都可以发生取代反应 | |
| C. | 标况下,1 mol乙醇可与足量的Na反应生成22.4 L H2 | |
| D. | 乙酸可与NaHCO3溶液反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl加热分解只生成HCl和NH3,NH4I固体加热分解也只生成HI和NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 足量的CO2气体通入Na2SiO3中可生成NaHCO3; 足量的CO2气体通入石炭酸中也生成了NaHCO3 | |
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将实验室的废酸液和废碱液先进行理后再排放 | |
| B. | 乙烷与氯气制备一氯乙烷 | |
| C. | 以铜和浓硝酸为原料生产硝酸铜 | |
| D. | 加成反应、酯化反应和加聚反应最符合“原子经济性” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| B. | 常温常压下,28g乙烯和丙烯的混合气体中所含碳原子数目小于NA | |
| C. | 乙炔的摩尔质量为26g | |
| D. | 标准状态下,将22.4L乙醇溶于水后配成500mL溶液,所得溶液物质的量浓度为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .写出与A具有相同官能团的A的所有同分异构体的结构简式CH2=CH-CH2-COOH、CH3-CH=CH-COOH;
.写出与A具有相同官能团的A的所有同分异构体的结构简式CH2=CH-CH2-COOH、CH3-CH=CH-COOH;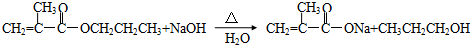 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com