
向两烧杯中加入相同体积的1.5mol/L的稀硫酸,置于天平的左右两托盘上,调节天平,使之达到平衡,向一个烧杯中加入5.4g镁,另一个烧杯中加入5.4g铝,试根据计算进行分析,当硫酸取不同体积时,反应完毕后,天平可能会发生的变化。
(1)金属均过量。此时硫酸的物质的量小于镁的物质的量。即:5.4g/24g/mol=0.225mol. V(H2SO4)<0.225/1.5=0.15L时,硫酸体积小于0.15L,硫酸完全反应,产生氢气的质量相等。天平平衡。
(2)酸过量,金属均完全反应。此时硫酸的物质的量大于铝反应时所需的硫酸物质的量。即:(5.4/27)*1.5 mol=0.3mol V(H2SO4)>0.3/1.5=0.2L时,镁、铝均完全反应,铝产生的氢气比镁多,天平向镁一侧倾斜。
(3)镁恰好完全反应,铝过量。此时硫酸的物质的量等于0.225mol,体积等于0.15L。两侧产生氢气的质量相等,天平平衡。
(4)镁完全反应且硫酸过量,而铝过量。此时硫酸的物质的量大于0.225mol,而小于0.3mol ,即体积在0.15L 到0.20L之间,铝产生氢气的质量比镁多,天平向镁一侧倾斜。
【解析】
试题分析: 因相同浓度、相同体积的稀硫酸,则质量相等,相同质量(wg)的镁和铝,则反应可能存在以下情况:
(1)金属均过量。此时硫酸的物质的量小于镁的物质的量。即:5.4g/24g/mol=0.225mol. V(H2SO4)<0.225/1.5=0.15L时,硫酸体积小于0.15L,硫酸完全反应,产生氢气的质量相等。天平平衡。
(2)酸过量,金属均完全反应。此时硫酸的物质的量大于铝反应时所需的硫酸物质的量。即:(5.4/27)*1.5 mol=0.3mol V(H2SO4)>0.3/1.5=0.2L时,镁、铝均完全反应,铝产生的氢气比镁多,天平向镁一侧倾斜。
(3)镁恰好完全反应,铝过量。此时硫酸的物质的量等于0.225mol,体积等于0.15L。两侧产生氢气的质量相等,天平平衡。
(4)镁完全反应且硫酸过量,而铝过量。此时硫酸的物质的量大于0.225mol,而小于0.3mol ,即体积在0.15L 到0.20L之间,铝产生氢气的质量比镁多,天平向镁一侧倾斜。
考点:考查质量守恒定律及其应用,以及化学方程式计算的相关知识点。


科目:高中化学 来源:2013-2014广东省珠海市高三学业质量监测二模理综化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42— |
B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 | 氧化性:Br2>Fe3+>I2 |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
D | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省湛江市高三年级第二次模拟理综化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | M | R | Q | |
原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
最低负价 | —— | -1 | —— | —— | -3 | -2 | |
下列说法正确的是( )
A.元素X和Q形成的化合物中不可能含有共价键
B.X、Z、R的最高价氧化物的水化物之间可两两相互反应
C.R3-比Q2-更容易失去电子
D.M(OH)2的碱性比XOH的碱性强
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的相对分子质量为
A.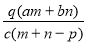 B.
B.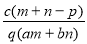
C.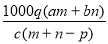 D.
D. 
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
除去氯气中混有的少量的氯化氢气体,最好选用
A.水 B.饱和食盐水
C.纯碱溶液 D.饱和烧碱溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷乙(解析版) 题型:选择题
mg气体A和ng气体B的分子数相等,下列说法不正确的是( )
A.同体积的气体A和气体B的质量比为m:n
B.25℃时,1kg气体A和1kg气体B的分子数比为n: m
C.同温同压时气体A和气体B的密度比为n:m
D.标况时,等质量的A和B气体的体积比为n:m
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:推断题
(本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下:
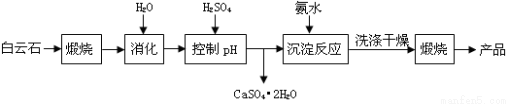
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%。
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石 。若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 (填序号)。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。则由图示可得到的结论及原因是:

①pH过高会导致___________________________下降,其原因是_______________________
②pH过低会引起____________________________ ,其原因可能是__________(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质 B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
根据上表数据,简要说明析出CaSO4.2H2O的操作步骤是 、 。
(4)写出沉淀反应中的离子方程式: 。
(5)该生产流程中还可得到的一种副产品是_______________。
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,
向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的
颜色为 (25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)。
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高考预测理综化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.钢铁在潮湿的空气中比在干燥空气中更容易生锈
B.粗铜精炼时,电解液中的c(Cu2+)保持不变
C.配制溶液时俯视容量瓶刻度线定容会使溶液浓度偏高
D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省梅州市高一下学期期中化学试卷(解析版) 题型:选择题
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是

A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com