
| A. | 锌片溶解了32.5 g | B. | 锌片增重32.5 g | ||
| C. | 铜片上析出lgH2 | D. | 铜片上析出1molH2 |
分析 锌-铜-稀硫酸组成的原电池装置中,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答 解:该原电池放电时,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以电池反应式为
Zn+H2SO4=ZnSO4+H2 ↑.
设当导线中有1mol电子通过时,理论上负极锌片溶解xg,铜片上析出氢气ymol.
Zn+H2SO4=ZnSO4+H2 ↑ 转移电子
65g 1mol 2mol
x y 1mol
x=32.5g
y=0.5mol.
故锌溶解了32.5g,而不是增重,故A正确、B错误;
铜片上生成了0.5mol氢气,质量为1g,故C正确、D错误、
故选AC.
点评 本题以原电池原理为载体考查了物质的量的有关计算,难度不大,根据电池反应式计算即可.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.C原子结构示意图
B原子的核外电子排布式1s22s22p63s23p2,C原子的价电子排布式3s23p5.C原子结构示意图
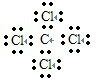 ,结构式
,结构式 ,中心原子Asp3杂化,立体构型是非极性 (填“极性”或“非极性”)分子.
,中心原子Asp3杂化,立体构型是非极性 (填“极性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol•(L•min) -1 | B. | 18mol•(L•min)-1 | C. | 0.6mol•(L•min) -1 | D. | 0.4mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有效地利用现有新能源和开发新能源已受到各国的重视.
有效地利用现有新能源和开发新能源已受到各国的重视.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 被鉴别的物质 | 鉴别物质(或鉴别方法) | 现象(填入序号即可) |
| 新制氢氧化铜 | ||
| 碘水 | ||
| 硝酸 | ||
| 灼烧 | ||
| 银氨溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对此有机物的下列叙述中,正确的是( )
对此有机物的下列叙述中,正确的是( )| A. | 在该有机物分子中,仅含有一种官能团 | |
| B. | 在一定条件下该1mol有机物可与2molH2发生加成反应 | |
| C. | 该有机物能在任何条件下都不能发生取代反应 | |
| D. | 该有机物能与银氨溶液发生银镜反应,但不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用激光笔鉴别淀粉溶液与氯化钠溶液 | |
| B. | 用KOH溶液鉴别NH4Cl、AlCl3、MgSO4、FeCl3四种溶液 | |
| C. | 用盐酸溶液鉴别Na2CO3溶液和Na2SiO3溶液 | |
| D. | 用BaCl2溶液鉴别AgNO3和Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com