
����Ŀ������̼�����Ҫ����ʳƷ��ҽҩ����ҵ���Ծ�ѡʯ��ʯ����������MgCO3��FeCO3���ʣ�Ϊԭ���Ʊ�����̼��ƵĹ����������£�

��1�������п���ѭ�����õ������������������__________���ѧʽ����
��2����̼����ʱ������Ӧ�����ӷ���ʽΪ________________���ù�����ͨ��������������˳����________________��
��3����ҵ�ϳ��õ���Ȼ��ƺ��Ȼ������������Ʊ������ƣ�ԭ������ͼ��ʾ��

�ٵ������У������Ȼ��Ƶ�Ŀ����________________��
��ʯī�缫�����ĵ缫��Ӧ����ʽΪ________________��
�۵��õ���Na��Լ��1%��Ca����ȥ��������Ca�ķ���Ϊ________________��
��֪�������ʵ��۷е����±���

���𰸡� NH4Cl Ca2+ + CO2 + 2NH3 + H2O��CaCO3�� + 2NH4+ ��ͨ�������������ͨ����� ���͵���ʵ������¶ȣ������ܺ� 2Cl����2e����Cl2�� �����¶���370K��1123K������
����������ѡʯ��ʯ���յõ�����þ�����������������ƺ�����������̼����������Ȼ�什�ȡ����˫��ˮ������ȷ����������ת��Ϊ�����ӣ��ټ��������Ƶ���pH�����������·�Ӧ�õ������Ϊ��������ʹ�����ӡ�þ����ת��Ϊ���������ˣ�����Ϊ����������������þ�����˺����Һ���Ȼ���Ϊ���ʣ���ͨ�������İ�������ͨ�������Ķ�����̼���õ��Ȼ�狀�̼��ƣ����˵õ���ҺΪ�Ȼ�泥�����Ϊ̼��ơ�
��1���ù����п���ѭ��ʹ�õ������Dzμӷ�Ӧ���̣���Ӧ�������ɵ����ʿ���ѭ��ʹ�ã�����ͼ�����ж�����������ֱ�Ϊ������̼�Ͱ���������ѭ��ʹ�ã�������ҺNH4ClҲ����ѭ��ʹ�ã���2����̼����ʱ�Ȼ�����Һ��ͨ�백���Ͷ�����̼����̼��ƺ��Ȼ�泥�������Ӧ�����ӷ���ʽΪCa2+ + CO2 + 2NH3 + H2O��CaCO3�� + 2NH4+�������ܽ�ȴ�Ϊ��֤�ܽ�������壬�ù�������ͨ�������������ڼ�����Һ��ͨ�������3���ٵ������У������Ȼ��Ƶ�Ŀ���ǽ��͵���ʵ������¶ȣ������ܺģ�����Ϊ���ý���������Ȼ�������ʱ������Ϊ��������ʯī�缫Ϊ�����������ĵ缫��Ӧ����ʽΪ2Cl����2e����Cl2�����۵��õ���Na��Լ��1%��Ca����ȥ��������Ca�ķ���Ϊ�����¶���370K��1123K������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊ98%��Ũ����(����1.84 g��cm��3)����240 mL 1.84 mol��L��1ϡ���ᣬ���в�����ȷ����(����)
A. ������ˮ����ע��ʢ��һ����Ũ������ձ��У������Ͻ�������ȴ
B. ����Ķ���������100 mL��Ͳ��250 mL����ƿ��������ƽ
C. ��ȡŨ��������Ϊ25.0 mL
D. ��������ƿ�м�������ˮ�������õ�Ũ����ע������ƿ����ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. �Ȼ�����Һ�ܽ�ͭƬ��Fe3��+ Cu��Fe2��+ Cu2��
B. ������ˮ��Ӧ��Cl2 + H2O ![]() 2H+ + Cl��+ ClO��
2H+ + Cl��+ ClO��
C. ��������Һ�м��������ˮ��Ag+ + NH3��H2O��AgOH��+ NH4+
D. Ca(HCO3)2��Һ������NaOH��Һ��Ӧ�� Ca2��+ HCO3��+ OH����CaCO3��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ɵ��������ܸ����Ŀ������ĸо�����Ҫ���㾫���ƾ���ˮ���ɵ���ˮ���ܰ�����ʿ���������㾫���溬���������ʣ���ҵ����AΪ��Ҫԭ�����ϳ�������������ϳ�·������ͼ��ʾ������A��ʯ���ѽ�������Ҫ�ɷ֣�A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����֪2CH3CHO+O2![]() 2CH3COOH����ش��������⣺
2CH3COOH����ش��������⣺
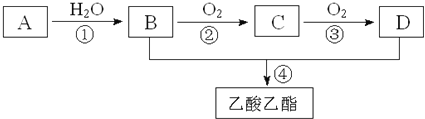
��1��д��A�ĵ���ʽ__________��
��2��B��D�����ں��еĹ����ŷֱ���__________��__________�������ƣ���
��3��д�����з�Ӧ�ķ�Ӧ���ͣ���______________����______________��
��4��д�����з�Ӧ�Ļ�ѧ����ʽ��
��__________________________________________________��
��__________________________________________________��
��__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Yohiaki Nakao����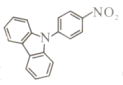 (b)��Pd���¿ɷ���Buchwald-Hartwigż����Ӧ������˵������ȷ����
(b)��Pd���¿ɷ���Buchwald-Hartwigż����Ӧ������˵������ȷ����
A. b�ķ���ʽΪC18H12N2O2
B. b��һ�ȴ�����4��
C. b�ɷ���ȡ����Ӧ
D. b������ԭ�Ӳ�һ����ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��СCO2�Ի�����Ӱ�죬�ڳ�������̼����ͬʱ�������ǿ��CO2�������õ��о���T1 ��ʱ����9 mol CO2��12 mol H2����3 L�ܱ������У�������ӦCO2(g)��3H2(g) ![]() CH3OH(g)��H2O(g)����H��0��������CH3OH�����ʵ�����ʱ��仯����������ʾ��ƽ��ʱ������ѹǿΪp1���ı�ijһ�������½���������Ӧ��CH3OH�����ʵ�����ʱ��仯����������ʾ������˵���������
CH3OH(g)��H2O(g)����H��0��������CH3OH�����ʵ�����ʱ��仯����������ʾ��ƽ��ʱ������ѹǿΪp1���ı�ijһ�������½���������Ӧ��CH3OH�����ʵ�����ʱ��仯����������ʾ������˵���������

A. ��������Ӧ�������ı�������ѹǿ
B. T2 ��ʱ��������Ӧƽ�ⳣ��Ϊ0.42����T2��T1
C. ��T1 ��������ʼʱ�������г���5 mol CO2��5 mol H2��5 mol CH3OH(g)��5 mol H2O(g)�����ƽ��ǰv(��)��v(��)
D. ��T1 ��������ʼʱ�������г���4.5 mol CO2��6 mol H2��ƽ��ʱ������ѹǿp��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������Ҫ����2molL��1��NaCl��Һ950mL������ʱӦѡ�õ�����ƿ�Ĺ��ͳ�ȡ��NaCl�����ֱ��ǣ� ��
A.950 mL��111.2 g
B.1000 mL��117 g
C.500 mL��117 g
D.1000 mL��111.2 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪNA������˵����ȷ����
A. �ö��Ե缫���KOH��Һ,����������5.6L����,���·��ͨ��0.5NA����
B. ���³�ѹ��.4.6gNO2���������ķ�����Ϊ0.1NA
C. 7.8gNa2O2��������ˮ(H218O)��Ӧ���ɵ�����������������ΪNA
D. 100g46%����(HCOOH)ˮ��Һ��������ԭ����Ϊ5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������֭�������ǵķ����ǣ������мӼ�������ԣ��ټ������Ʊ���Cu(OH)2�����ȣ���������______________��
��2���л���E��̼���⡢������Ԫ����ɣ����������Ƿ��͵õ���Ҳ�ɴ���ţ������ȡ��������EΪ��ɫճ��Һ�壬������ˮ����֪E�ķ���ʽΪC3H6O3����
��ʵ��֤ʵ���к����ǻ����Ȼ���������E�Ľṹ��ʽΪ______________��
��д��E������Na��Ӧ�Ļ�ѧ����ʽ_____________________________________��
��д��E������NaHCO3��Ӧ�Ļ�ѧ����ʽ_________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com