
| 选项 | 物质(杂质) | 试剂 |
| A | Al2O3(SiO2) | 过量NaOH溶液 |
| B | CO2(HCl) | 饱和Na2CO3溶液 |
| C | Na2O2(Na2O) | O2/加热 |
| D | Al2O3(Fe2O3) | Al粉/加热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二者都与氢氧化钠溶液反应;
B.二者都与碳酸钠溶液反应;
C.加热条件下,氧气与氧化钠反应生成过氧化钠;
D.氧化铁生成铁,氧化铝中仍含有杂质.
解答 解:A.二者都与氢氧化钠溶液反应,不能用于除杂,故A错误;
B.二者都与碳酸钠溶液反应,应用饱和碳酸氢钠溶液除杂,故B错误;
C.加热条件下,氧气与氧化钠反应生成过氧化钠,可用加热的方法除杂,故C正确;
D.氧化铁生成铁,氧化铝中仍含有杂质,不能用于除杂,故D错误.
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意把握实验的可行性的评价,题目难度不大.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2+2OH-═CO32-+H2O | B. | Al2O3+2OH-+═2 AlO2-+H2O | ||
| C. | Al3++4OH-═AlO2-+2H2O | D. | 2 Al+2OH-+6H2O═2 AlO2-++3 H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3气体(H2O):通过浓H2SO4干燥 | |
| B. | FeCl2溶液(FeCl3):加入铁粉,过滤 | |
| C. | CO气体(CO2):通过NaOH溶液洗气后干燥 | |
| D. | Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实际应用 | 化学原因 | |
| A | “84”消毒液和洁厕灵不能混合使用 | 发生化学反应产生有毒气体 |
| B | FeCl3腐蚀Cu刻制印刷电路板 | 铁比铜金属性强 |
| C | 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | 酸、碱还有盐可直接侵蚀铝的保护膜以及铝制品本身 |
| D | 明矾、硫酸铁可作净水剂 | 溶于水形成胶体从而凝聚水中的悬浮物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a | b | c | 现象 | 结论 | 装置 |
| A | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | H2CO3酸性大于H2SiO3 | 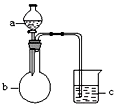 |
| B | 浓盐酸 | MnO2 | 石蕊 试液 | 石蕊试液先 变红后褪色 | 氯气具有漂白性 | |
| C | 稀硫酸 | 锌粒 | 水 | 一段时间有气泡 | 反应生成了H2 | |
| D | NaOH溶液 | Al | 水 | 产生大量气泡 | Al能与NaOH 溶液反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水热反应”是一种复杂的化学变化 | |
| B. | 二氧化碳与超临界水作用生成汽油的反应,属于放热反应 | |
| C. | 火力发电厂可望利用废热,将二氧化碳转变为能源物质 | |
| D. | 随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com