
【题目】下图表示几种中学常见物质之间的相互转化关系(图中部分条件或产物已省略),其中B为黑色的非金属固体单质,D可使品红溶液褪色,E在通常状况下是无色无味的液体,I在通常状况下是无色气体,G是淡黄色的固体化合物,H是黑色晶体. 
请回答下列问题:
(1)单质F的组成元素在周期表中的位置是(指明周期和族),G的电子式为 , 化合物J的俗名 .
(2)金属Al和H的混合物俗称
(3)镁条能在气体C中燃烧得到两种固体,其化学式分别是、;
(4)写出上图中下列反应的化学方程式:
①;
③;
(5)向上图中的反应⑤得到的M、N混合液中通入H2S气体,溶液变浑浊,酸性增强.请写出该过程发生反应的离子方程式: .
【答案】
(1)第四周期第Ⅷ族;![]() ;纯碱
;纯碱
(2)铝热剂
(3)MgO;C
(4)C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O;3Fe+4H2O(g)
CO2↑+2SO2↑+2H2O;3Fe+4H2O(g) ![]() ?Fe3O4+4H2
?Fe3O4+4H2
(5)2Fe3++H2S═2Fe2++S↓+2H+
【解析】解:B为黑色的非金属单质,应为C,D可使品红溶液褪色,应为SO2 , 则A为H2SO4 , E在通常状况下是无色无味液体,应为H2O,则C为CO2 , G是淡黄色的固体化合物,应为Na2O2 , 则I、J应为Na2CO3和O2 , I在通常状况下是无色气体,I为O2 , J为Na2SO4 , H是黑色晶体,反应④为铝热反应,则F为Fe,H为Fe3O4 , 与稀硫酸反应生成硫酸铁和硫酸亚铁.
(1.)由以上分析可知F为Fe,位于周期表第四周期第Ⅷ族,G为Na2O2 , 电子式为 ![]() ,J应为Na2CO3和O2 , J的俗名为纯碱,所以答案是:第四周期第Ⅷ族;
,J应为Na2CO3和O2 , J的俗名为纯碱,所以答案是:第四周期第Ⅷ族; ![]() ;纯碱;
;纯碱;
(2.)H为Fe3O4 , 金属Al和H的混合物俗称为铝热剂,所以答案是:铝热剂;
(3.)镁条能在CO2中燃烧得到两种固体,其化学式分别是MgO、C,所以答案是:MgO、C;
(4.)反应①为C和浓硫酸在加热条件下发生氧化还原反应,反应的化学方程式为C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O,反应③为Fe和水蒸气在高温下反应生成Fe3O4和H2 , 反应的化学方程式为3Fe+4H2O(g)
CO2↑+2SO2↑+2H2O,反应③为Fe和水蒸气在高温下反应生成Fe3O4和H2 , 反应的化学方程式为3Fe+4H2O(g) ![]() Fe3O4+4H2 , 所以答案是:C+2H2SO4(浓)
Fe3O4+4H2 , 所以答案是:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O;3Fe+4H2O(g)
CO2↑+2SO2↑+2H2O;3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
(5.)M、N混合液中含有Fe3+ , 具有强氧化性,可与H2S发生氧化还原反应,反应的离子方程式为2Fe3++H2S═2Fe2++S↓+2H+ , 所以答案是:2Fe3++H2S═2Fe2++S↓+2H+ .


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】某元素构成的双原子单质分子有三种,其式量分别为158、160、162.在天然单质中,此三种单质的物质的量之比为1:1:1,由此推断以下结论中,正确的是( )
A.此元素有三种同位素
B.其中一种同位素质量数为80
C.其中质量数为79的同位素原子占原子总数的 ![]()
D.此元素的单质的平均式量为160
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼金厂的废水中含有CN﹣有剧毒,其性质与卤素离子相似,还原性介于I﹣与Br﹣之间,HCN为弱酸.下列说法不正确的是
A.CN﹣可以和稀硫酸反应生成HCN
B.CN﹣可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被F﹣还原
D.常温下NaCN溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关环境保护的说法中错误的是( )
A. 研制开发燃料电池汽车,消除机动车尾气污染
B. 加大石油、煤炭的开采速度,增加化石燃料的供应量
C. 含甲醛、苯及其同系物的装修材料对人体有害
D. 随意丢弃废旧电池会造成重金属盐对土壤和水源的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月季花适宜生长在酸性土壤里,某同学给月季花施肥前,对下列氮肥溶液的pH进行了测定,结果如下:
化肥名称 | 尿素 | 碳酸氢铵 | 硫酸铵 | 氨水 |
溶液的pH | 7 | 8 | 5 | 11 |
该同学最好选用( )
A. 尿素 B. 碳酸氢铵
C. 硫酸铵 D. 氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,是白色砂状或淡黄色粉末固体,己知连二业硫酸钠在碱性条件下较稳定,易被空气氧化,不溶于甲醇,遇水迅速分解,某同学设计利用如下图所示的实验装置制备一定量的连二亚硫酸钠,装置C中的试剂为甲酸钠(HCOONa)、NaOH 的甲醇溶液,回答下列问题:
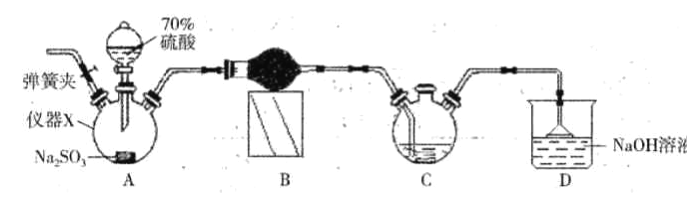
(1)仪器X的名称是_____。装置B中的球形干燥管中盛装的试剂是_______。
(2)装置D的作用是___________。实验时需要将C中温度控制在70-75℃,最好的控制方法是__________。
(3)实验开始时先打开装置A中的弹簧夹通入一段时间N2的目的是______。实验过程中装置C 中除有气体产生外,还能观察到的实验现象为____________。
(4)有同学通过仔细思考后认为,还应在C、D 之间添加一个装置,才能确保C中生成能稳定存在的连二亚硫酸钠,则该装置应具有的功能是______。为得到较纯的连二亚硫酸钠,需要对在过滤时得到的连二亚硫酸钠进行洗涤,洗涤的方法是_________。
(5)若实验中所用Na2SO3的质量为12.6g (硫酸是过量的),最终得到m g干燥的连二亚硫酸钠,则连二亚硫酸钠的产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)水的电离平衡曲线如下图所示。
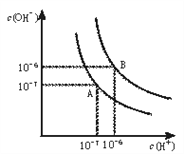
将100℃下的pH=8的Ba(OH)2溶液与100℃下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7, 则Ba(OH)2与盐酸的体积比为______________
(2)下列关于水电离的说法正确的是(____)
A.水电离是熵增加的反应,反应吸热,故能自发进行
B.升高温度水分子的活化分子数增多,有效碰撞几率减小,电离速率加快
C.向水中加入多电子体,加快H+和O2-之间的电子传递, 破坏水的电离平衡,是研究水分解的方向之一
D.水电离本质上是水分子间的氢键瞬间作用力加强造成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com