
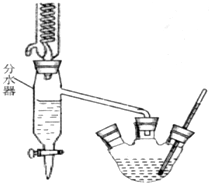
 已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题:
已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题:分析 (1)水-乙醇-环己烷能形成三元共沸物,减少生成物,促进平衡向正反应方向移动;
(2)沸点低的物质先被蒸馏得到;
(3)碱性物质能中和酸性物质且酯在碳酸钠溶液中的溶解度较小;苯甲酸乙酯易溶于乙醚,难溶于水,根据苯甲酸乙酯在不同溶剂中的溶解度不同答题;
(4)乙醚易挥发,说明乙醚沸点较低,苯甲酸乙酯沸点高于乙醚,根据沸点不同进行物质分离,用蒸馏的方法.
解答 解:(1)根据题干信息知,苯甲酸和乙醇反应生成苯甲酸乙酯和水,水-乙醇-环己烷能形成三元共沸物,使用分水器的目的是使水量减少,生成物的量减少,导致平衡向正反应方向移动,即分离反应生成的水,促进酯化反应正向进行,
故答案为:分离反应生成的水,促进酯化反应正向进行;
(2)沸点低的物质先被蒸馏得到,三元共沸物的熔点较低,导致三元共沸物先被蒸馏得到,所以该液体的三种主要成分是水、乙醇、环己烷,
故答案为:水、乙醇、环己烷;
(3)碳酸钠为强碱弱酸盐,碳酸钠溶液呈碱性,能和酸反应而除去酸,碳酸钠溶液能降低酯的溶解度,所以用碳酸钠溶液溶液中和至弱碱性分液,苯甲酸乙酯易溶于乙醚,难溶于水,所以水层用乙醚萃取,进一步获得苯甲酸乙酯,
故答案为:碳酸钠;萃取;
(4)乙醚易挥发说明乙醚的沸点较低,苯甲酸乙酯沸点较高,加热时,沸点低的先蒸出、沸点高的后蒸出,所以将醚层加入到干燥的蒸馏烧瓶中进行蒸馏,先蒸出乙醚、后蒸出苯甲酸乙酯,
故答案为:蒸馏;乙醚.
点评 本题考查了物质制备,明确实验原理是解本题关键,根据实验原理及物质的性质来分析解答,很多学生对有机化学实验知识了解较少,解答时易出现错误,要熟练掌握教材基础知识,灵活运用基础知识来分析解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3 $\stackrel{高温}{→}$CaO $\stackrel{{H}_{2}O}{→}$Ca(OH)2$→_{过滤}^{N{a}_{2}C{O}_{3}溶液}$ NaOH溶液 | |
| B. | Cu$→_{△}^{O_{2}}$CuO$→_{△}^{H_{2}SO_{4}}$CuSO4溶液$→_{过滤}^{NaOH溶液}$Cu(OH)2沉淀 | |
| C. | KMnO4$\stackrel{△}{→}$O2$\stackrel{s}{→}$SO2$\stackrel{{H}_{2}O}{→}$H2SO3 | |
| D. | BaCO3$\stackrel{盐酸}{→}$BaCl2溶液$\stackrel{NaOH溶液}{→}$Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
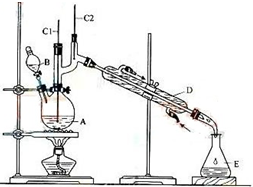 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
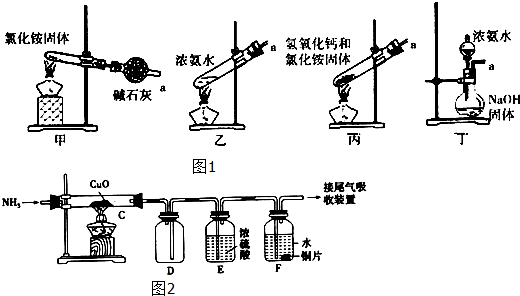
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
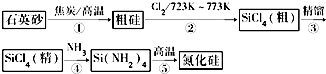
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛待测液的锥形瓶用蒸馏水洗后未用待测液润洗 | |
| B. | 滴定管尖嘴部分在滴定前有气泡 | |
| C. | 滴定管在滴定前未将刻度调在“0.00”,而调在“2.40” | |
| D. | 滴定达终点时,滴定管尖嘴部分有气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com