
某200 mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
A. 0.4 mol/L B. 2 mol/L
C. 0.8 mol/L D. 1.0 mol/L
科目:高中化学 来源: 题型:
NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,其充分的理由是( )
A. NH3分子是非极性分子
B.分子内3个N—H键的键长相等,键角相等
C. NH3分子内3个N—H键的键长相等,3个键角都等于107°18′
D. NH3分子内3个N—H键的键长相等,3个键角都等于120°
查看答案和解析>>
科目:高中化学 来源: 题型:
固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是( )
A. NH5中既有共价键、又有离子键,是离子化合物
B. 1molNH5中有5NA个N—H键(NA为阿伏加德罗常数)
C.NH5跟水的反应是氧化还原反应
D.NH5跟水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
等量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A.1:1 B.3:4
C.2:3 D.4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能在强碱性溶液中大量共存的是( )
A.K+、Na+、SO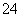 、NO
、NO
B.H+、Na+、Cl-、SO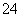
C.Cu2+、K+、Cl-、SO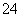
D.Ca2+、NH 、CO
、CO 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的性质决定了物质的用途,下面列出了金属的几种性质:①导热性 ②导电性 ③还原性 ④延展性 ⑤具有金属光泽。请在下面金属用途后的横线上填上金属性质对应的序号。
(1)用铝锭制成包装用的铝箔________;
(2)用铝制成的高压铝锅________;
(3)用铁粉回收照相业废液中的银________;
(4)电信业中大量使用的铜丝、金属电缆________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于苯酚的叙述不正确的是( )
A.苯酚是一种弱酸,滴加指示剂变色
B.苯酚在水溶液中能按下式电离:
C.苯酚钠在水溶液中几乎不能存在,会水解生成苯酚,所以苯酚钠溶液显碱性
D.苯酚有腐蚀性,溅在皮肤上可用酒精冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。

请回答下列问题:
(1)反应①的离子方程式是__________ ____
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是__ _____。
(3)反应②N2+3H2 2NH3 △H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不 变”)。如 该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
2NH3 △H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不 变”)。如 该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
A.单位时间内生成nmol N2同时消耗3nmol H2 B.混合气体的密度不变
C.混合气体的平均摩尔质量不变 D. N2、H2、NH3浓度之比为1:3:2
(4)H2NCOONH4 (氨基甲酸铵)是合成尿素的中间体,H2NCOONH4在水溶液中要发生水解反应,其水解反应的离子方程式为:____ __。
 (5)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要CH4__ _m3 (标准状况)。
(5)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要CH4__ _m3 (标准状况)。
(6) 化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为______ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤。请回答下列问题:
⑴ 该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
⑵ 某温度下,2SO2(g)+O2(g)  2SO3(g) △H=-196 kJ•mol-1。
2SO3(g) △H=-196 kJ•mol-1。
在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,
半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol•L-1•min-1,放出的热量为 kJ。
 ⑶ 一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。
⑶ 一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。
⑷ 将一定量的SO2和0.7 molO2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com