
| A. | KW=1×10-14 | B. | 大于1×10-14 | C. | 小于1×10-14 | D. | 0.01 |
科目:高中化学 来源: 题型:选择题
| A. | 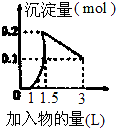 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合溶液中逐滴加入0.1mol/l是H2SO4溶液 | |
| B. | 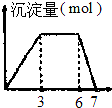 向含0.1mol/L的AlCl3和0.3mol/LNH4Cl的1L混合溶液中逐滴加入0.1mol/l是NaOH溶液 | |
| C. | 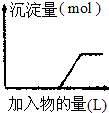 向烧碱溶液中逐滴加入明矾溶液 | |
| D. | 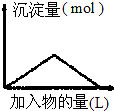 向Ba(OH)2溶液中逐渐通入二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和H2催化加热制取氨气 | B. | 加热NH4Cl制取氨气 | ||
| C. | 将浓氨水向氧化钙固体上滴加 | D. | 将NH4Cl溶液和NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别溶液中是否有SO42-,先用盐酸酸化,再加BaCl2溶液 | |
| B. | 干馏、分馏都是物理变化 | |
| C. | 往制备乙酸乙酯反应后的混合液中加入Na2CO3溶液,产生气泡,说明乙酸有剩余 | |
| D. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被还原的H2SO4为0.2moL | |
| B. | 反应中共转移电子0.1moL | |
| C. | 反应消耗了金属Cu6.4g | |
| D. | 生成的CuSO4配成500mL溶液,浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(KJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com