
H![]() CaC2O4↓(白色)+2H2O
CaC2O4↓(白色)+2H2O
为探究乙二酸晶体(H

回答下列问题:
(1)乙二酸晶体(H
(2)a处试剂的名称是________________,反应一段时间后a处的现象为____________。
(3)足量澄清石灰水的作用是________________。
装置乙不能缺少,理由是_________________。
(4)丙中b处逸出的气体可能是________________。检验的方法是_______________(用化学方程式表示)。
(5)简述检查上述装置气密性的方法:__________________。
(6)乙二酸还可能具有的性质是_________________。(填序号)
A.能与银氨溶液发生银镜反应 B.能使酸性KMnO4溶液褪色
C.能与Na2CO3反应生成CO2 D.能使蓝墨水褪色
解析:该题属于物质验证性实验。首先推测乙二酸的分解产物,然后根据产物的性质特点和验证方法确定验证顺序,设计出合理的实验方案,分别加以验证。
H
验证CO2时需通过Ca(OH)2溶液,所以H
(5)检查装置气密性时应注意先将b管口浸入水中,然后利用酒精灯微热甲中试管,通过观察现象判断。
(6)乙二酸中无醛基,不能发生银镜反应,A错误。H
答案:(1)H![]() CO↑+CO2↑+3H2O
CO↑+CO2↑+3H2O
(2)无水硫酸铜 白色粉末变蓝色
(3)验证产物中有CO2
乙二酸晶体受热易升华,导致产生的气体中可能含有乙二酸蒸气,与石灰水反应也能产生白色浑浊现象,干扰CO2的检验;冷却即可除去气体中的乙二酸
(4)CO
2CO+O2![]() 2CO2,CO2+Ca(OH)2
2CO2,CO2+Ca(OH)2![]() CaCO3↓+H2O(或CO+CuO
CaCO3↓+H2O(或CO+CuO![]() Cu+CO2,CO2+Ca(OH)2
Cu+CO2,CO2+Ca(OH)2![]() CaCO3↓+H2O)
CaCO3↓+H2O)
(5)将装置丙的管口b浸入水中,给甲中的试管微热,若管口有连续气泡逸出,冷却后水进入管口形成一小段水柱,并保持不变,说明装置气密性好
(6)BCD


科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
H![]() CaC2O4↓(白色)+2H2O
CaC2O4↓(白色)+2H2O
为探究乙二酸晶体(H

回答下列问题:
(1)乙二酸晶体(H
(2)a处试剂的名称是______________,反应一段时间后a处的现象为__________________。
(3)足量澄清石灰水的作用是____________________________________。
装置乙不能缺少,理由是________________________________________________。
(4)丙中b处逸出的气体可能是___________。检验的方法是___________(用化学方程式表示)。
(5)简述检查上述装置气密性的方法:____________________________________________。
(6)乙二酸还可能具有的性质是______________________。(填序号)
A.能与银氨溶液发生银镜反应
B.能使酸性KMnO4溶液褪色
C.能与Na2CO3反应生成CO2
D.能使蓝墨水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
已知乙二酸(HOOC―COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为_________________________________________。
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_________________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,
据此,乙二酸分解的产物为___________________________。上述装置中,D的作用是_____
__________________________________________。装置F中发生反应的化学方程式为:
___________________________________________________________。
(4)该小组同学将2.52 g草酸晶体(H2C2O4•2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是______________________
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省高三12月月考(理综)化学部分 题型:实验题
已知乙二酸(HOOC―COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为_________________________________________。
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_________________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,
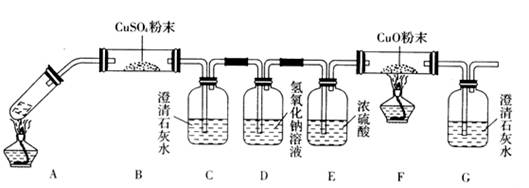
据此,乙二酸分解的产物为___________________________。上述装置中,D的作用是_____
__________________________________________。装置F中发生反应的化学方程式为:
___________________________________________________________。
(4)该小组同学将2.52 g草酸晶体(H2C2O4•2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是______________________
________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com