
【题目】某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%。300 mL该溶液中氯离子的物质的量约等于( )
A. 0.37 mol B. 0.63 mol C. 0.74 mol D. 1.5 mol
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
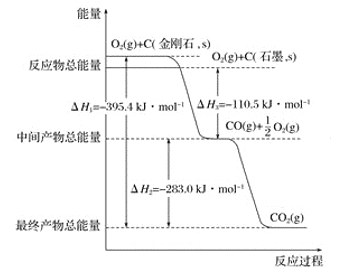
(1)等质量的金刚石和石墨完全燃烧,____________(填“金刚石”或“石墨”)放出的热量更多,写出表示石墨完全燃烧的热化学方程式:_______________________________________
(2)在通常状况下,____________(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式: _______________________________________________________________。
(3)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程中放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二锰(Mn2O3)在现代工业上应用广泛。以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备高纯度硫酸锰进而制备三氧化二锰的工艺流程如下(两种矿物中均不存在单质杂质):
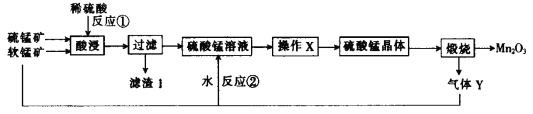
(1)MnS、Mn2O3、MnO2中锰元素的化合价均不同,已知锰有多种化合价,请再写出两种含锰且锰的化合价不同的化合物的化学式:______________。
(2)滤渣1中存在一种非金属单质,则“酸浸”时反应①的化学方程式为________________。
(3)操作X为蒸发浓缩、________、________、洗涤烘干。经操作X之后得到MnSO4H2O。在洗涤操作中,常用酒精洗涤MnSO4H2O晶体,主要目的是_______________________。
(4)气体Y直接排放会污染空气,将Y的水溶液与软锰矿反应可得硫酸锰,反应②的化学方程式为______。
(5)Mn2O3与MnO2类似,也能与浓盐酸反应,其反应的离子方程式为____________。
(6)用标准的BaCl2溶液测定样品中MnSO4H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其原因可能是_________________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少1个电子层,E原子得1个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如下图所示。
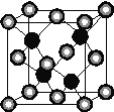
请回答下列问题:
(1)E元素的电负性________(填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是___,M2E2是____(填“极性”或“非极性”)分子。
(4)L的价电子排布式为________,该元素位于周期表中的________族。
(5)R的化学式为____________(用元素符号表示),属于________晶体。已知R晶体的密度为ρg·cm-3,则该晶胞的边长a________cm。(阿伏伽德常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为___,在该反应中NaClO3和Na2SO3的物质的量之比为________。
(2)有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是________。
(3)化学小组的同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他们进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是________。
②已知Ksp(AgCl)=1.780×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.000×10-3mol·L-1。试计算此时溶液中Cl-的浓度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸反应制备乙烯,化学方程式为:C2H5OH![]() CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
CH2=CH2↑+H2O,接着再用液溴与乙烯反应制备1,2-二溴乙烷。在制备过程中由于部分乙醇与浓硫酸发生氧化还原反应还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体。某学习小组用上述三种为原料,组装下列仪器(短接口或橡皮管均己略去)来制备1,2-二溴乙烷
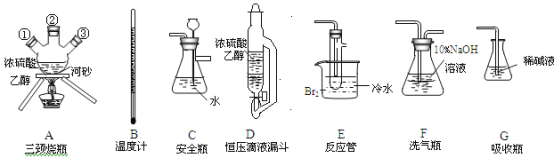
(1)如果气体流向从左到右,正确的连接顺序是:
B经A①插入A中,D接入②;A③接__接__接___接___。
(2)温度计水银球的正确位置是_________。
(3)装置D与分流漏斗相比,其主要优点是_______。
(4)装置C的主要作用是_______,装置F的作用是__________。
(5)在反应管E中进行的主要反应的化学方程式为________。
(6)装置E烧杯中的泠水和反应管内液溴上的水层作用均是_______________。若将装置F拆除,在E中的主要反应为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)前四周期中的一部分如图,若B元素原子序数为x,则A、C、D、E原子序数之和为(________________)
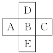
(2)核内中子数为N的R2+,质量数为A,则它的n g氧化物中所含质子的物质的量是(______)mol
(3)最外层电子数为2的元素有 _______ (填元素符号,下同)。
最外层电子数与次外层电子数相等的元素有________
(4)在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是____ 、 ____ 、 ____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是

A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2的导电能力之和大于HA的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 有机物的同系物具有相同的通式,且组成相差n(n>0的正整数)个CH2原子团,因此等质量的同系物完全燃烧时消耗氧气的物质的量相差1.5nmol
B. 根据卤代烃的消去反应一定能判断卤代烃中所含卤素原子的种类
C. 饱和一元醇可在一定条件下与氢卤酸发生取代反应
D. 分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4―二甲基戊烷或3,3―二甲基戊烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com