
【题目】填空
(1)某元素原子的质量数为A,它的阴离子Xn﹣核外有x个电子,w克这种元素的原子核内中子的物质的量为mol
(2)在K2SO4和KCl的混合溶液中,K+的物质的量浓度为1.2mol/L,SO42﹣的物质的量浓度为0.4mol/L,则此溶液中Cl﹣的物质的量浓度为:
(3)写出二氧化氮与水的反应方程式 , 氧化剂与还原剂的物质的量比为 .
(4)从1L1molL﹣1NaCl溶液中取出200mL溶液,取出的溶液中NaCl的物质的量浓度是molL﹣1 , 取出的溶液中NaCl的物质的量是mol,质量是g.
【答案】
(1)![]()
(2)0.4mol/L
(3)3NO2+H2O═2HNO3+NO;1:2
(4)1;0.2;11.7
【解析】解:(1)元素原子的质量数为A,w克这种元素的原子,其物质的量为 ![]() mol,
mol,
阴离子Xn﹣核外有x个电子,则质子数为x﹣n,
原子核内中子数为A﹣(x﹣n)=A﹣x+n,
则w克这种元素的原子核内中子数为 ![]() mol×(A﹣x+n)=
mol×(A﹣x+n)= ![]() mol,所以答案是:
mol,所以答案是: ![]() mol;(2)根据混合液中的电荷守恒可得:c(K+)+c(H+)=2c(SO42﹣)+c(OH﹣)+c(Cl﹣),由于溶液呈中性,则c(H+)=c(OH﹣),
mol;(2)根据混合液中的电荷守恒可得:c(K+)+c(H+)=2c(SO42﹣)+c(OH﹣)+c(Cl﹣),由于溶液呈中性,则c(H+)=c(OH﹣),
所以c(K+)=2c(SO42﹣)+c(Cl﹣),则c(Cl﹣)=c(K+)﹣2c(SO42﹣)=1.2mol/L﹣0.4mol/L×=0.4mol/L,所以答案是:0.4mol/L;(3)NO2与水发生反应:3NO2+H2O═2HNO3+NO,NO2既是氧化剂又是还原剂,被氧化的NO2生成HNO3 , 被还原NO2的生成NO,所以氧化剂与还原剂的物质的量比为1:2,所以答案是:3NO2+H2O═2HNO3+NO;1:2;(4)溶液具有均一性,浓度和体积的大小无关,从1L 1molL﹣1NaCl溶液中取出200mL溶液,取出的溶液中NaCl的物质的量浓度是1mol/L,取出的溶液中NaCl的物质的量是n=cV=1mol/L×0.2L=0.2mol,质量是m=nM=0.2mol×58.5g/mol=11.7g,所以答案是:1;0.2;11.7.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化,不能通过一步反应实现的是
A. S→SO2→SO3 B. A1→Al2O3→Al(OH)3
C. Fe→FeCl2→Fe(OH)2 D. NH3→NO→NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数,下列说法正确的是( )
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.2g氢气所含原子数目为NA
C.在常温常压下,11.2L氮气所含原子数目为NA
D.标准状况下,22.4L氧气所含原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
(A) | 盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
(B) | 冰醋酸 | 铝热剂 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
(C) | 纯碱 | 天然气 | 苛性钾 | 氢硫酸 | 碳酸钙 |
(D) | 玻璃 | 盐酸 | 氯化钠 | 次氯酸 | 氯气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
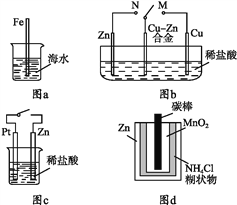
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

请回答:
(1)甲池中正极是_______负极是________负极反应式:________________。
(2)乙池中负极是__________正极是__________,总反应的离子方程_______。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出___活动性更强,而乙会判断出___活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?___(填写字母序号)。
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”,这种做法______(填“可靠”或“不可靠”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题: 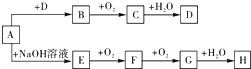
(1)写出下列物质的化学式:A , B , C .
(2)写出下列反应的化学方程式:E→F;D的浓溶液与木炭反应的方程式:
(3)检验某溶液中是否含D中阴离子的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应可表示为a+b→c+d+H2O(未配平,条件略去)。下列叙述中正确的是( )
A. 若b为浓硝酸,则c,d不可能同时为气体
B. 若a为Cl2,则c,d一定为漂白粉成分
C. 若a为H+,则c,d可能为沉淀和气体
D. 若反应后为蓝色溶液,该反应需加热才可以发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl﹣、SO42﹣、和NO3﹣的相互分离.相应的实验过程可用下图表示:请回答下列问题: 
(1)写出实验流程中下列物质的化学式:试剂X , 沉淀A .
(2)按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 .
(3)上述实验流程中加入过量的Na2CO3的目的是 , 确认Na2CO3已过量的实验方法是:
(4)写出步骤①中发生反应的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com