
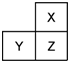
 X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | 气态氢化物的热稳定性:X>Z | |
| B. | 原子半径:X<Y<Z | |
| C. | Y和Z的最高价氧化物对应水化物均为强酸 | |
| D. | 若Z的最高正价为+m,则X的最高正价也一定为+m |
分析 X、Y、Z是三种短周期的主族元素,由各元素在周期表中的位置可知,X处于第二周期,Y、Z处于第三周期,X原子的最外层电子数是其次外层电子数的3倍,原子有2个电子层,X最外层电子数为6,故X为O元素,则Z为S元素,Y为P元素,结合元素周期律进行解答.
解答 解:X、Y、Z是三种短周期的主族元素,由各元素在周期表中的位置可知,X处于第二周期,Y、Z处于第三周期,X原子的最外层电子数是其次外层电子数的3倍,原子有2个电子层,X最外层电子数为6,故X为O元素,则Z为S元素,Y为P元素.
A.同主族自上而下非金属性减弱,故非金属性X>Z,氢化物稳定性与元素非金属性一致,则氢化物稳定性X>Z,故A正确;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Y>Z>X,故B错误;
C.硫酸属于强酸,但磷酸属于中强酸,故C错误;
D.S元素最高正化合价为+6,氧元素一般没有正化合价,故D错误.
故选A.
点评 本题考查结构性质位置关系应用,难度不大,整体把握元素周期表是元素推断的关键,有利于基础知识的巩固,注意主族元素最高正化合价的特殊性.


科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl,无沉淀析出 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++SO32-+H2O | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl和AgNO3 | B. | Na2CO3和稀盐酸 | C. | Al2(SO4)3和NaOH | D. | 盐酸和Na[Al(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题: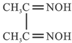 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用480 mL 容量瓶 | |
| B. | 把烧碱固体放在纸上称量 | |
| C. | 把称好的固体放入容量瓶中稀释至刻度线 | |
| D. | 定容时俯视容量瓶的刻度线浓度偏大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com