
����Ŀ��A��B��C��D��Ϊ��ѧ�����Ĵ����A�ǵ���������֮�������µķ�Ӧ��ϵ��

(1)��B����̬�⻯�C��D����������C������������Ҫ���ʡ�B��C�ɷ�Ӧ����A��д���÷�Ӧ�Ļ�ѧ����ʽ��___________________��
(2)��A��̫���ܵ���õĹ�����ϣ�BΪA���ʵ������C��DΪ���Σ������������ơ������Ԫ��Ϊͬһ���塣��д��B��C�����ӷ���ʽ��__________��
(3)��BΪ����ɫ���壬�ڢ۷�Ӧ���õ�ͬһ��Һ̬�⻯�D���ʳ�����ʳƷ��ҵ��д��B��C�Ļ�ѧ����ʽ��__________��
(4)��D���ʾ������ԣ��ڢ۷�Ӧ��Ҫ��ǿ����Һ���ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���壬д��C��D�����ӷ���ʽ��__________��
(5)��A��Ӧ����㷺�Ľ������ܷ�Ӧ�õ�A���ڢݷ�Ӧ���õ�ͬһ�ַǽ������ʡ�д��C��D�����ӷ���
ʽ��__________��
���𰸡� SO2+2H2S=3S��+2H2O SiO2+2OH��=SiO32��+H2O 2Na2O2+2H2O=4NaOH+O2�� AlO2��+CO2+2H2O=Al(OH)3��+HCO3����[Al(OH)4]��+CO2=Al(OH)3��+HCO3�� 2Fe3++Fe=3Fe2+
��������(1)��B����̬�⻯�C��D����������C������������Ҫ���ʡ�B��C�ɷ�Ӧ����A����AΪS��BΪH2S��CΪSO2��DΪSO3��SO2+2H2S=3S��+2H2O��(2)��A��̫���ܵ���õĹ�����ϣ�BΪA���ʵ������C��DΪ���Σ������������ơ������Ԫ��Ϊͬһ���塣��д��B��C�����ӷ���ʽ��SiO2+2OH-�TSiO32-+H2O��(3)��BΪ����ɫ���壬�ڢ۷�Ӧ���õ�ͬһ��Һ̬�⻯�D���ʳ�����ʳƷ��ҵ����AΪNa,BΪNa2O2��C��ΪNaOH��DΪNaHCO3��д��B��C�Ļ�ѧ����ʽ��2Na2O2+2H2O=4NaOH+O2�� ����4����D���ʾ��������ƶ�DΪAl(OH)3 ���ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���壬˵��CΪƫ������NaAlO2���ڢ۷�Ӧ��Ҫ��ǿ����Һ���ж�AΪAl��BΪAlCl3������AΪAl��Ԫ�������ڱ��е�λ���ǵ������ڢ�A�壬C��D�����ӷ���ʽ��AlO2��+CO2+2H2O=Al(OH)3��+HCO3����[Al(OH)4]��+CO2=Al(OH)3��+HCO3�� ����5����A��Ӧ����㷺�Ľ������ƶ�ΪFe���ܷ�Ӧ�õ�A���ڢݷ�Ӧ���õ�ͬһ�ַǽ������ʣ��ƶ�ΪCl2��C����Һ����ʴ��ӡˢͭ��·�壬�ж�CΪFeCl3��DΪFeCl2��C����Һ����ʴ��ӡˢͭ��·�壬C��D�����ӷ���ʽΪ��Fe+2Fe3���T3Fe2����


 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ�����������ʢװ���Ũ���ᣮΪ�о����Ʋ������ȵ�Ũ����ķ�Ӧ��ijѧϰС�����������̽�����
��1����̽��һ��
��.���ѳ�ȥ�����������������̼�ظ֣��������Ũ�����У�10min��Ͷ������ͭ��Һ�У�Ƭ�̺�ȡ���۲죬�������������Ա仯����ԭ���� ��
��.����ȡ����6.0g����15.0mLŨ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y��
�ټ�ͬѧ��ΪX�г�Fe3+����ܺ���Fe2+ �� ��Ҫȷ�������Ƿ���Fe2+ �� Ӧѡ��������ţ���
a��KSCN��Һ��������ˮ
b�����ۺ�KSCN��Һ
c��Ũ��ˮ
d������KMnO4��Һ
����ͬѧȡ336mL����״��������Yͨ��������ˮ�У�������Ӧ��SO2+Br2+2H2O�T2HBr+H2SO4 �� Ȼ���������BaCl2��Һ�����ʵ�������2.33g������壮�ɴ���֪����Y��SO2���������Ϊ ��
��2����̽������
��������ʵ��������SO2�������������ͬѧ��Ϊ����Y�л����ܺ���H2��Q���壮Ϊ���������ͼ��ʾ��̽��ʵ��װ�ã�ͼ�мг�������ʡ�ԣ���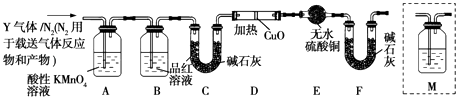
��װ��B���Լ��������� ��
����Ϊ����Y�л����ܺ���Q�����������û�ѧ����ʽ��ʾ����
��Ϊȷ��Q�Ĵ��ڣ�������װ��M��������ţ���
a��װ��A֮ǰ b��װ��A��B��
c��װ��B��C�� d��װ��C��D��
���������Y�к���H2 �� ʵ������Ӧ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȷ��ȡ25.00mLKMnO4��Һ����ѡ�õ������ǣ� ��
A.25mL��ͲB.25mL��ʽ�ζ���
C.25mL��ʽ�ζ���D.�п̶ȵ�50mL�ձ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�͵��ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ���������û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC(s)+2NO (g)![]() N2(g)+CO2(g) ��H= QkJ/mol��
N2(g)+CO2(g) ��H= QkJ/mol��
��T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�

(1)0��10min�ڣ�NO��ƽ����Ӧ����V(NO)=______��T1��,�÷�Ӧ��ƽ�ⳣ��K=________��
(2) 30 min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı������������______.������ĸ��ţ���
a��ͨ��һ������NO b������һ�����Ļ���̿
c��������ʵĴ��� d���ʵ���С���������
(3)��30 min�������¶���T2�����ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3:1:1����Q_____0������>������<"����
(4)�ں��������£����жϸ÷�Ӧһ���ﵽ��ѧƽ��״̬��������______����ѡ���ţ���
a����λʱ��������2nmol NO (g)��ͬʱ����nmol CO2(g) b����Ӧ��ϵ���¶Ȳ��ٷ����ı�
c�����������ܶȲ��ٷ����ı� d����Ӧ��ϵ��ѹǿ���ٷ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ֲ����к�ϡ�ٵĶ�ͪɫ�أ���ʳƷ��������Ҫ���ڹ�ͷ����±��Ʒ�ȵ���ɫ�����������������������仯ѧ�ϳ�·�����£����ֲ����������ȥ����ش�
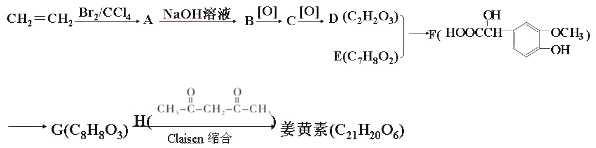
��֪����![]()
��Claisen���ϣ���R1��R2��R3��R4��ʾ�������⣩��

��1��H���ӵĺ˴Ź����������֮��Ϊ_____��C�Ļ�ѧ����Ϊ_____��D�Ľṹ��ʽΪ_____��
��2����A��B�ķ�Ӧ����Ϊ_____����D��E����F�Ļ�ѧ����ʽΪ_____���÷�Ӧ�ķ�Ӧ����Ϊ_____
��3��ͬʱ��������������E��ͬ���칹�干��_____�֣�д������һ�ֽṹ��ʽ_____��
����FeCl3��Һ����ɫ�������ϵ�һ�ȴ��������֣�
��4����֪�����ؾ��гƽṹ��д�������صĽṹ��ʽ_____��
��5���۱�ϩȩ![]() �����ںϳ��л��߷���ɫ�أ�����Claisen���Ϸ�Ӧ������Լ�ȩ����ȩΪԭ�Ϻϳɾ۱�ϩȩ��·�ߣ��ϳ�·������ͼʾ�����£�H2C�TCH2
�����ںϳ��л��߷���ɫ�أ�����Claisen���Ϸ�Ӧ������Լ�ȩ����ȩΪԭ�Ϻϳɾ۱�ϩȩ��·�ߣ��ϳ�·������ͼʾ�����£�H2C�TCH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH��_____��
CH3CH2OH��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ��;��
��1�����̼�Ȼ�ԭһ��������ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
Al2O3��s��+AlC13��g��+3C��s���T3AlCl��g��+3CO��g����H=a��kJmol��1
3AlCl��g���T2Al��l��+AlC13��g����H=b��kJmol��1
�ú�a��b�Ĵ���ʽ��ʾ��Ӧ��Al2O3��s��+3C��s��=2Al��l��+3CO��g������H=_____kJmol��1��
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC��s��+2NO��g��N2��g��+CO2��g����H=Q��kJmol��1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�ʱ�䵥λΪmin,Ũ�ȵ�λΪmol/L����
| 0 | 10 | 20 | 30 |
NO | 1.00 | 0.68 | 0.50 | 0.50 |
N2 | 0 | 0.16 | 0.25 | 0.25 |
CO2 | 0 | 0.16 | 0.25 | 0.25 |
��0��10min�ڣ�NO��ƽ����Ӧ����v��NO��=_____��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=_____��
��30min�������¶���T2�����ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3��1��1����Q_____0�����������������������T����
���ں��������£����жϸ÷�Ӧһ���ﵽ��ѧƽ��״̬��������_____������ѡ���ţ���
a����λʱ��������2nmolNO��g����ͬʱ����nmolCO2��g��
b����Ӧ��ϵ��ѹǿ���ٷ����ı�
c�����������ܶȱ��ֲ���
d����������ƽ����Է����������ֲ���
����������������Ӧǰ30min�ķ�Ӧ�������䣬��ʼʱNO��Ũ��Ϊ2.50mol/L����Ӧƽ��ʱc��NO��=_____mol/L��NO��ת����_____������������������С����������������
��3��ֱ���ŷ�úȼ�ղ������������������صĻ������⣬��ȼú�����Ķ�����̼�������ã��ɴﵽ��̼�ŷŵ�Ŀ�ģ���ͼ��ͨ���˹�������ã���CO2��H2OΪԭ���Ʊ�HCOOH��O2��ԭ��ʾ��ͼ���缫b���淢���ĵ缫��ӦʽΪ_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ʵ�����Ժ�����ͭмΪԭ���Ʊ�Cu��NO3��23H2O���壬����һ��̽����SOCl2�Ʊ�������ˮCu��NO3��2����Ƶĺϳ�·�����£�
��֪����Cu��NO3��23H2O![]() Cu��NO3��2Cu��OH��2
Cu��NO3��2Cu��OH��2![]() CuO
CuO
��SOCl2�۵㩁105�����е�76������ˮ����ˮ�����������������塢ˮ��ǿ�ҷ��ȣ�
��ش�
��1��Cu������ϡHNO3��Ӧ�Ļ�ѧ����ʽ_____
��2����������pH�ʺϵ�������_____���ѧʽ����
��3����������������Ũ������ȴ�ᾧ�����˵Ȳ��裬��������Ũ���ľ��������_____��Ϊ�õ��ϴ������Cu��NO3��23H2O���壬�ɲ��õķ�����_____����һ�֣���
��4���������з����ķ�Ӧ��ѧ����ʽ��_____��
��5����������ijͬѧ��Ƶ�ʵ��װ��ʾ��ͼ����ͼ1����һ����������������Ľ�������˵�����ɣ�_____��װ�øĽ���������A�л����μ�SOCl2ʱ�������_____������a������b������a��b��������Ӧ�����У����ܻ����¶ȹ��߶��и���Ӧ��д��������Ч��ʩ_____��_____��
��6��Ϊ�ⶨ��ˮCu��NO3��2��Ʒ�Ĵ��ȣ����÷ֹ��ȷ���
��֪��4NH3H2O+Cu2+�TCu��NH3��42++4H2O��Cu��NH3��42+���ض�����������ճ̶ȣ��������A��ʾ����Cu2+��һ��Ũ�ȷ�Χ�ڳ����ȣ��ֲ��Cu��NH3��42+�������A��Cu2+����ҺŨ�ȹ�ϵ��ͼ2��ʾ��
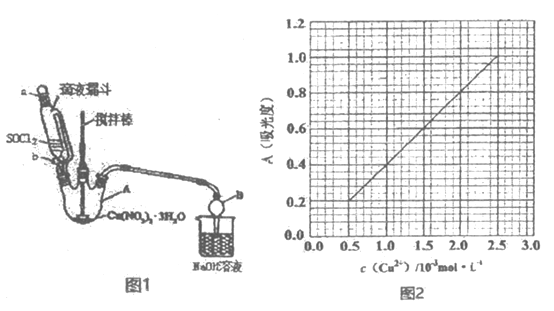
ȷ��ȡ0.315 0g��ˮCu��NO3��2��������ˮ�ܽⲢ������100mL��ȷ��ȡ����Һ10.00mL���ӹ���NH3H2O����������ˮ������100mL�������Һ�����A=0.600������ˮCu��NO3��2��Ʒ�Ĵ�����_____��������������ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20����30�����Eyring��Pzer����ײ���۵Ļ����������ѧ��Ӧ�Ĺ���̬���ۣ���ѧ��Ӧ������ͨ������ײ������ɵģ������ڷ�Ӧ�ﵽ������Ĺ����о���һ���������Ĺ���̬����ͼ��H2O��CO��Ӧ����CO2��H2�����е������仯ʾ��ͼ����ͼ��֪��CO2��H2��������������ڡ�����С�ڡ����ڡ���H2O��CO������������÷�Ӧ��������ȡ����ȡ�����Ӧ�� 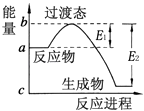
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������أ�����˵����ȷ����
A�����ۡ���֬�͵����ʶ��Ǹ߷��ӻ�����
B��ú��������Һ�������ڻ�ѧ�仯
C�������ķ���������β����ֱ���ŷ���
D���ϳ���ά���ά�����������ǽ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com