
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

【答案】1s22s22p3 1 +1 大 4 sp2 共价 ![]() ×100%
×100%
【解析】
(1)根据N、Ga的原子序数,结合原子构造原理分析解答;
(2)根据电离能差值分析元素的化合价,电离能差值过大说明失去该电子较困难,同周期元素随着原子序数增大,电负性增强,同主族元素随着原子序数增大,电负性增强;根据同一周期元素的电负性变化规律分析比较;
(3)一个Ga与4个O相连,据此判断配位数;
(4)利用价层电子对互斥模型判断原子杂化方式;
(5)GaAs为原子晶体,原子间以共价键结合;利用均摊法计算一个晶胞中含有的As、Ga原子数,通过计算晶胞体积、晶胞中As、Ga的总体积就可计算出原子的体积占晶胞体积的百分率。
(1)N是7号元素,核外电子排布式是1s22s22p3,Ga是31号元素,位于第四周期第IIIA,核外电子排布式是[Ar]3d104s24p1,应用一个轨道最多可容纳2个自旋方向相反的电子,所以在3d、4s轨道上电子成对,只有4p电子是成单电子,故Ga原子核外有1个未成对电子;
(2)根据Ga失去电子的逐级电离能数值,第一电离能和第二电离能差值较大,且第三电离能和第四电离能数值差别较大,说明失去第二个电子和失去第四个电子较困难,所以呈现的价态是+1和+3;Ga、As是同一周期的元素,一般情况下,同一周期的元素,原子序数越大,元素的非金属性越强,其电负性越大,所有电负性As>Ga;
(3)一个Ga与4个O相连,所以Ga的配位数为4;
(4) (CH3)3Ga中Ga形成3个δ键,没有孤电子对,所有Ga原子的杂化方式为sp2杂化;
(5) GaAs为原子晶体,原子间以共价键结合;利用均摊法计算一个晶胞中含有的As、Ga原子数,As:8×![]() +6×
+6×![]() =4,Ga:4×1=4,即一个晶胞中含有4个GaAs;由于晶胞的密度为ρg·cm-3,晶胞的质量m=
=4,Ga:4×1=4,即一个晶胞中含有4个GaAs;由于晶胞的密度为ρg·cm-3,晶胞的质量m=![]() g,所以晶胞的体积V=
g,所以晶胞的体积V=![]() cm3;4个Ga原子的体积为V(Ga)=
cm3;4个Ga原子的体积为V(Ga)=![]() cm3;4个As原子的体积为V(As)=
cm3;4个As原子的体积为V(As)=![]() cm3;所以GaAs晶胞中原子的体积占晶胞体积的百分率为
cm3;所以GaAs晶胞中原子的体积占晶胞体积的百分率为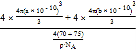 ×100%=
×100%=![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4 +16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出上述反应电子转移的方向和数目。____
(2)该反应中氧化剂是___,被氧化的元素是___,若有1mol的KMnO4参加反应,则可以氧化___mol的HCl,转移的电子数目为____mol,得到的氯气的体积为___L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
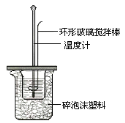
(1)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏 大、偏小、无影响”)
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由__
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
2/3Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=_____________,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正)___v(逆) (填“>” “=” “<”),反应经过2min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____,CO的平衡转化率=____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A、减少Fe的量 B、增加Fe2O3的量 C、移出部分CO2 D、提高反应温度 E、减小容器的容积 F、加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MoS2(辉钼矿的主要成分)可用于制取钼的化合物润滑添加剂氢化反应和异构化反应的催化剂等。回答下列问题:
(1)反应3MoS2+18HNO3+12HCl=3H2[MoO2Cl4]+18NO↑+6H2SO4+6H2O中,每溶解1mol MoS2,转移电子的物质的量为___________。
(2)已知:MoS2(s)= Mo(s)+S2(g) △H1
S2(g)+2O2(g)=2SO2(g) △H2
2MoS(s)+7O2(g)=2MoO3 (s)+4SO2(g) △H3
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=___________(用含△H1、△H2、△H3的代数式表示)。
(3)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液(装置如图所示)。

①阴极的电极反应式为______________________。
②一段时间后,电解液的pH___________ (填“增大”“减小”或“不变”),MoO42-在电极___________(填“A”或“B”)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是_______________________。
(4)用辉钼矿冶炼Mo的反应为
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。
①该反应的△H___________(填“>”或“<”)0;p1、p2、p3按从小到大的顺序为___________。
②在某恒容密闭容器中加入0.1 mol MoS2、0.2mol Na2CO3、0.4mol H2,一定温度下发生上述反应,下列叙述说明反应已达到平衡状态的是____________ (填标号)。
a.v正(H2)=v逆(CO)
b.气体的密度不再随时间变化
c.气体的压强不再随时间变化
d单位时间内断裂H一H键与断裂H—O键的数目相等
③在2L的恒温恒容密闭容器中加入0.1 mol MoS2、0.2 mol Na2CO3、0.4molH2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是一种中等活泼金属,化合价为+2价和+3价,其中CoC12易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:
(1)甲同学用Co2O3与盐酸反应制备CoC124H2O,其实验装置如下:

①烧瓶中发生反应的离子方程式为______。
②由烧瓶中的溶液制取干燥的CoC124H2O,还需经过的操作有蒸发浓缩、______、洗涤、干燥等。
(2)乙同学利用甲同学制得的CoC124H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdC12溶液能被CO还原为Pd。

①装置E、F是用于检验CO和CO2的,其中盛放PdC12溶液的是装置______(填“E”或“F”)。
②装置G的作用是______;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是______。
③通氮气的作用是______。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是______。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是

A. 传感器工作时,工作电极电势高
B. 工作时,H+通过交换膜向工作电极附近移动
C. 当导线中通过1.2×l0-6 mol电子,进入传感器的甲醛为3×10-3 mg
D. 工作时,对电极区电解质溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )

A. 0.5% B. 1.0% C. 0.1% D. 1.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com