
【题目】氮气是一种不活泼的气体,其根本原因是
A. 氮元素的非金属性较弱B. 氮原子的半径较小,核对最外层电子吸引力强
C. 氮气是双原子分子D. 使氮气分子的氮氮叁键断裂需要吸收很高的能量
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是( )
X | Y | Z | W | |
A | C | CO | CO2 | O2 |
B | Na | Na2O | Na2O2 | O2 |
C | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
D | Fe | FeCl2 | FeCl3 | Cl2 |
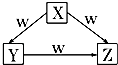
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)3C(g)+D(s),达到平衡时,C的浓度为1.2mol/L.若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol/L,则D的起始物质的量应满足的条件应是( )
A.大于0.6mol
B.大于零
C.等于1mol
D.任意值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10﹣a mol/L,c(OH﹣)=10﹣b mol/L,已知a+b=13,则在该温度下,将100mL 0.10mol/L的稀硫酸与100mL 0.40mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)( )
A.11.52
B.11.70
C.11.82
D.12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中一定正确的是( )
A.固态时能导电的物质一定是金属晶体
B.熔融状态能导电的晶体一定是离子晶体
C.水溶液能导电的晶体一定是离子晶体
D.固态不导电而熔融状态导电的晶体一定是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。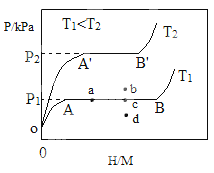
在OA段,氢溶解于M中形成固溶体MHx , 随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)=zMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z= (用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v= mLg-1min-1。反应的焓变△HⅠ 0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1) η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的 点(填“b”“c”或“d”),该贮氢合金可通过 或 的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为 。已知温度为T时:CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165KJmol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41KJmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL 4molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为 ( )
A.0.21mol
B.0.25mol
C.0.3mol
D.0.35mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10﹣a mol/L,c(OH﹣)=10﹣b mol/L,已知a+b=13,则在该温度下,将100mL 0.10mol/L的稀硫酸与100mL 0.40mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)( )
A.11.52
B.11.70
C.11.82
D.12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示: 
(1)95℃时水的离子积KW=
(2)95℃时,0.01mol/LNaOH溶液的PH= .
(3)95℃时水的电离平衡曲线应为(填“A”或“B”),请说明理由 .
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
(5)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 .
(6)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析原因: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com