
����Ŀ��һ�������£���ij�ܱ������м���һ������N2��H2�������淴ӦN2(g)+3H2(g)![]() 2NH3(g) ��H=-92.2kJmol-1������10����ʱ��ƽ�⡣���0��10���ڣ�c(H2)��С��0.75molL-1������˵����ȷ����
2NH3(g) ��H=-92.2kJmol-1������10����ʱ��ƽ�⡣���0��10���ڣ�c(H2)��С��0.75molL-1������˵����ȷ����
A.10��15����c(NH3)����������0.25molL-1
B.10���ڰ�����ƽ����Ӧ����Ϊ0.025molL-1��s-1
C.��ƽ����������NH3��v������
D.�÷�Ӧ���淴Ӧ�Ļ�ܲ�С��92.2kJmol-1
���𰸡�D
��������
A. ���0��10���ڣ�c(H2)��С��0.75molL-1����c(NH3)������0.5molL-1������������㣬10��15����c(NH3)����������0.25molL-1�������ŷ�Ӧ�Ľ��У�ƽ����Ӧ���ʲ��ϼ���������10��15����c(NH3)������С��0.25molL-1��A����
B. 10���ڰ�����ƽ����Ӧ����Ϊ![]() molL-1��s-1��B����
molL-1��s-1��B����
C. ��ƽ����������NH3��ƽ�������ƶ�����v����������ֻ����С��C����
D. �÷�Ӧ���淴Ӧ�Ļ��Ϊ����Ӧ�Ļ��+92.2kJmol-1��D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�Ϊ��ʽ���ڱ���һ���֣����еı�Ŵ�����Ӧ��Ԫ�ء�
�� | |||||||||||||||||
�� | �� | ||||||||||||||||
�� | �� | �� | �� | �� | |||||||||||||
�� | �� |
��ش��������⣺
��1�����Т������______��Ԫ�ء�
��2���ۺ͢��γɵ�һ�ֳ����ܼ������������ռ乹��Ϊ________��
��3��Ԫ�آٺ͢��γɵ������X����________����(���������������Ǽ�����)
��4��Ԫ�آĵ�һ������________Ԫ�آߵĵ�һ�����ܣ�Ԫ�آڵĵ縺��________Ԫ�آܵĵ縺��(ѡ����>��������������<��)��
��5��Ԫ�آ�Ļ�̬ԭ�Ӻ���۵����Ų�ʽ��________��
��6��Ԫ�آ�͢��γɵĻ�����ĵ���ʽΪ________��
��7��ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ������Ԫ�آ���Ԫ�آݵ��������������Ƶ����ʡ���д��Ԫ�آ������������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ҹ����Ƶ�����ּ���������������̼������������������ǵ��¼�����������Ҫ���أ�
![]() ����̿�����ڴ���������Ⱦ��NO����1L�����ܱ������м���
����̿�����ڴ���������Ⱦ��NO����1L�����ܱ������м���![]() NO��
NO��![]() �������̿
�������̿![]() ������
������![]() ����������E������
����������E������![]() ���¶ȷֱ���
���¶ȷֱ���![]() ��
��![]() ʱ�����ƽ��ʱ�����ʵ����ʵ������±���
ʱ�����ƽ��ʱ�����ʵ����ʵ������±���
| ����̿ | NO | E | F |
|
|
|
|
|
|
|
|
|
|
![]() ����ϱ����ݣ�д��NO�����̿��Ӧ�Ļ�ѧ����ʽ ______ ��
����ϱ����ݣ�д��NO�����̿��Ӧ�Ļ�ѧ����ʽ ______ ��
![]() ������Ӧ��ƽ�ⳣ������ʽ
������Ӧ��ƽ�ⳣ������ʽ![]() ______ ������������Ϣ�жϣ�
______ ������������Ϣ�жϣ�![]() ��
��![]() �Ĺ�ϵ�� ______ ��
�Ĺ�ϵ�� ______ ��
A.![]() B.
B.![]() C.���Ƚ�
C.���Ƚ�
![]() ��
��![]() �·�Ӧ�ﵽƽ������д�ʩ�ܸı�NO��ת���ʵ��� ______ ��
�·�Ӧ�ﵽƽ������д�ʩ�ܸı�NO��ת���ʵ��� ______ ��
![]() ����
����![]()
![]() ����ѹǿ
����ѹǿ![]() �����¶�
�����¶�![]() ��ȥ����F
��ȥ����F
![]() ��ѭ�����ղ���������
��ѭ�����ղ���������![]() ���ͻ�����Ⱦ��ͬʱ�����Ƶ�
���ͻ�����Ⱦ��ͬʱ�����Ƶ�![]() ������������ͼ��ʾ
������������ͼ��ʾ

![]() �����ӷ���ʽ��ʾ��Ӧ���з����ķ�Ӧ ______ ��
�����ӷ���ʽ��ʾ��Ӧ���з����ķ�Ӧ ______ ��
![]() �û�ѧƽ���ƶ���ԭ����������HI�ֽⷴӦ��ʹ��Ĥ��Ӧ�������
�û�ѧƽ���ƶ���ԭ����������HI�ֽⷴӦ��ʹ��Ĥ��Ӧ�������![]() ��Ŀ���� ______ ��
��Ŀ���� ______ ��
![]() ��������Դ�ǽ��������Ⱦ����Ч;��֮һ��ֱ�Ӽ״�ȼ�ϵ��
��������Դ�ǽ��������Ⱦ����Ч;��֮һ��ֱ�Ӽ״�ȼ�ϵ��![]() ���
���![]() ���ڽṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע��DMFC����ԭ����ͼ��ʾ
���ڽṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע��DMFC����ԭ����ͼ��ʾ

ͨ��a����ĵ缫��ԭ��ص� ______ ��![]() ����������������
����������������![]() ��b�缫��ӦʽΪ ______ ��
��b�缫��ӦʽΪ ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ҵ��ˮ�к��д���![]() ���϶��
���϶��![]() ���������࣬ͨ���������̿ɴӸ÷�ˮ�л���
���������࣬ͨ���������̿ɴӸ÷�ˮ�л���![]() ���弰����Cu��
���弰����Cu��

![]() ����������______
����������______![]() �ѧʽ
�ѧʽ![]() ���Լ���Ϊ______
���Լ���Ϊ______![]() ����������
����������![]()
![]() ����3�з�����Ӧ�����ӷ���ʽΪ______
����3�з�����Ӧ�����ӷ���ʽΪ______
![]() ����4���漰�IJ����ǣ�����Ũ����______�����ˡ�ϴ�ӡ��������Ũ�������˲����о��õ��IJ���������______
����4���漰�IJ����ǣ�����Ũ����______�����ˡ�ϴ�ӡ��������Ũ�������˲����о��õ��IJ���������______
![]() ��ͭ�г���������������ͭ
��ͭ�г���������������ͭ![]() ��������ͭ��ϡ���ᷴӦ�����������ͭ��ͬʱ��Һ��������д���÷�Ӧ�����ӷ���ʽ______��
��������ͭ��ϡ���ᷴӦ�����������ͭ��ͬʱ��Һ��������д���÷�Ӧ�����ӷ���ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Anammox����һ�����͵İ���ȥ������������˵��������ȷ����

A. 1mol NH4+ ��������������Ϊ10NA
B. ������N2H4���к��м��Լ��ͷǼ��Լ�
C. ����II����������Ӧ������IV���ڻ�ԭ��Ӧ
D. ����I�У����뷴Ӧ��NH4+��NH2OH�����ʵ���֮��Ϊ1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӏ�������ֵ������˵����ȷ����
A. �����£�1L pH��13��Ba(OH)2��Һ��OH����Ϊ0.2NA
B. 2.4gþ�ڿ�������ȫȼ������MgO��Mg3N2��ת�Ƶĵ�����Ϊ0.2NA
C. ����ȼ�ϵ����������22.4L����ʱ���������ĵ����������ĿΪ2NA
D. 0.lmol/L(NH4)2SO4��Һ��0.2mol/LNH4Cl��Һ�е�NH4+��Ŀ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�¶��£�ij���������з�����ӦSO2(g)��NO2(g)![]() SO3(g)+NO(g)����ƽ�ⳣ��K=0.24������˵����ȷ����
SO3(g)+NO(g)����ƽ�ⳣ��K=0.24������˵����ȷ����
A.���¶��·�Ӧ2SO2(g)��2NO2(g)![]() 2SO3(g)+2NO(g)��ƽ�ⳣ��Ϊ0.48
2SO3(g)+2NO(g)��ƽ�ⳣ��Ϊ0.48
B.���÷�Ӧ��H<0���������¶Ȼ�ѧƽ�ⳣ��K��С
C.�������¶ȣ��淴Ӧ���ʼ�С
D.�ı�����ʹƽ�������ƶ�����ƽ��ʱ������![]() һ����ԭƽ��С
һ����ԭƽ��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�̶��ݻ����ܱ������г���2molA��1molB��������Ӧ��2A(��)+B(��) ![]() xC(��),�ﵽƽ���C���������ΪW%����ά������������¶Ȳ��䣬��0.6molA��0.3molB��1.4molCΪ��ʼ���ʣ��ﵽƽ���C�����������ΪW%����xֵΪ
xC(��),�ﵽƽ���C���������ΪW%����ά������������¶Ȳ��䣬��0.6molA��0.3molB��1.4molCΪ��ʼ���ʣ��ﵽƽ���C�����������ΪW%����xֵΪ
A. 1 B. 2 C. 3 D. 4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊԭ���Ʊ�![]() �Ĺ����������£�
�Ĺ����������£�
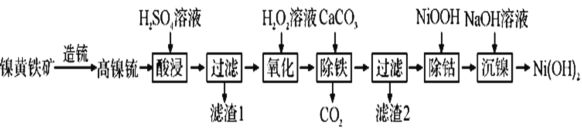
��֪���ٸ���ﳵ���Ҫ�ɷ�Ϊ![]() ��
��![]() ��
��![]() ��
��![]() �ĵͼ����P�Ͻ�
�ĵͼ����P�Ͻ�
�������ԣ�![]() ��
��
��![]() ��
�� ![]() ��
��![]() ��
��
�ش��������⣺
(1)�������ʱ��H2SO4��Һ���������Ŀ����________��
(2)��������ʱ����1����Ҫ�ɷ���________��
(3)��������ʱ��Ӧ�Ļ�ѧ����ʽΪ_________������NaClO����H2O2��Һ,ʹ0.2molFe2+ת��ΪFe3+������NaClO����Ϊ___mol��
(4)����������ԭ����_________��
(5)��������ʱ��������Ӧ�����ӷ���ʽΪ____________��
(6)��������������ˡ�ϴ�ӣ�֤��������ϴ�Ӹɾ��ķ�����_____�����������������Һ��![]() ������Һ��pH��____
������Һ��pH��____
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com