
【题目】下列现象中,能说明铝在氧气中燃烧是化学变化的是( )
A. 发出耀眼白光B. 生成白色粉末C. 放出大量的热D. 铝的质量减少
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备KMnO4晶体的操作流程:

已知:锰酸钾(K2MnO4)是墨绿色晶体,其水溶液呈深绿色,这是锰酸根离子(MnO42-)在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO42-会发生自身氧化还原反应,生成MnO4-和MnO2。
回答下列问题:
(1)KOH的电子式为______,煅烧KOH和软锰矿的混合物应放在_______中加热(填标号)。
a.烧杯 b.瓷坩埚 c.蒸发皿 d.铁坩埚
(2)调节溶液pH过程中,所得氧化产物与还原产物的物质的量之比为______。
(3)趁热过滤的目的是_______________________________。
(4)已知20℃时K2SO4、KCl、CH3COOK的溶解度分别为11.1g、34g、217g,则从理论上分析,选用下列酸中__________(填标号),得到的高锰酸钾晶体纯度更高。
a.稀硫酸 b.浓盐酸 c.醋酸 d.稀盐酸
(5)产品中KMnO4的定量分析:
①配制浓度为0.1250mg·mL-1的KMnO4标准溶液100mL。
②将上述溶液稀释为浓度分别为2.5、5.0、7.5、10.0、12.5、15.0(单位:mg·L-1)的溶液,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。

③称取KMnO4样品(不含K2MnO4)0.1250g按步骤①配得产品溶液1000mL,取10mL稀释至100mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.149、0.151,则样品中KMnO4的质量分数为____。
(6)酸性KMnO4溶液与FeSO4溶液反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如右图所示。下列结论正确的是
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如右图所示。下列结论正确的是
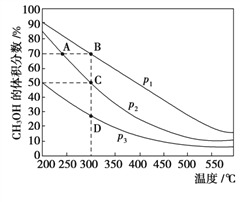
A. 该反应的ΔH>0 B. 平衡常数:K(C)< K(D)
C. 压强:p1>p2 D. 达到平衡时,反应速率:v(A)> v(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,表中所列字母分别代表一种元素

回答下列问题:
(1)h元素的名称是_________,九种元素中金属性最强的是_________(填元素符号)。
(2)f的最高价氧化物对应的水化物的化学式___________(填化学式)。
(3)b、c、d、e的原子半径依次___________(填增大或减小)。
(4)e、h元素的氢化物中,热稳定性大的是_________(填氢化物的化学式)。
(5)工业上冶炼g元素的单质的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3A(g)+B(g)![]() 2C(g)+2D(g) △H<0。右图中曲线a、b分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措
2C(g)+2D(g) △H<0。右图中曲线a、b分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措
施是( )
①增大A的浓度 ②升高温度
③增大D的浓度④加入催化剂
⑤恒温下,缩小反应容器的体积
⑥加入稀有气体,保持容器内压强不变

A. ①②③ B. ④⑤ C. ③④⑤ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.通式相同的不同物质一定属于同系物
B.完全燃烧某有机物,生成CO2 和 H2O 的物质的量之比为1 :1,该有机物只可能是烯烃或环烷烃
C.分子式相同而结构不同的化合物一定互为同分异构体
D.符合通式CnH2n-2(n≥3)的有机物一定是炔烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵可用作化肥、军用炸药、杀虫剂、冷冻剂,工业制取硝酸铵的工艺流程如下:

(1)N2分子的电子式为_____,NH3分子中含有的化学键类型是____________。
(2)乙装置中发生反应的化学方程式是_________,标准状况下,该反应生成2.24LNO气体转移的电子数目为______。
(3)生产硝酸排放的尾气中常含有NO、NO2,可用以下两种方法处理:
方法一:碱液吸收法。写出用其氧化钠溶液吸收NO、NO2生成亚硝酸钠的离子方程式_________。
方法二:甲烷吸收法。在恒压条件下,将一定量的CH4和NO2两种气体置于密闭容器中,发生CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有______(填字母)。
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有______(填字母)。
A.增加催化剂表面积 B.减小投料比:n(NO2)/n(CH4)
C.增大压强 D.升高温度
(4)配制100mL0.1mol·L-1NH4NO3溶液所需要的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和______。
(5)25℃时,下列关于硝酸铵溶液中的离子浓度关系不正确的是_____ 。
A.Kw/c(H+)>1×10-7mol·L-1 B.c(NO3-)>c(NH4+)>c(H+)>c(OH-)
C.c(H+)=c(OH-)+c(NH3·H2O) D.c(NH4+)+c(H+)=c(NO3-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com