
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
X | Y | Z | |
① | NaOH溶液 | NH4HCO3 | 稀硫酸 |
② | KOH溶液 | SO2 | 浓硫酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③B.①④C.②③D.②④
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成新燃料是发展低碳经济的重要方法,已知:CO(g) + 2H2(g)![]() CH3OH(g)是合成甲醇(CH3OH)的反应,该反应过程的能量变化如图所示,下列判断正确的是( )
CH3OH(g)是合成甲醇(CH3OH)的反应,该反应过程的能量变化如图所示,下列判断正确的是( )
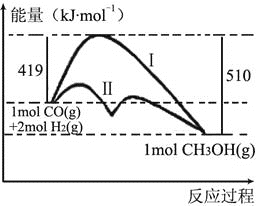
A. CO(g)与H2(g)反应生成1mol CH3OH(g)释放出91kJ的能量
B. 用碳制备原料气CO、H2的反应属于放热反应
C. 反应物总键能高于生成物的总键能
D. 若该反应生成液态CH3OH,则放出的能量更少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.原子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
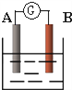
(1)若A为Pb,B为PbO2,电解质溶液为H2SO4溶液,电池的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。则该电池在工作时,A电极的质量将_______(填“增加”、“减小”或“不变”)。若该电池反应消耗了0.1mol H2SO4,则转移电子的数目为_______(设NA为阿伏加德罗常数的值)
(2)若A、B均为铂片,电解质溶液为KOH溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A极的电极反应式:__________________________;该电池工作一段时间后,溶液的碱性将___________(填“增强”、“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
A. 最终生成白色沉淀 B. 最终生成红褐色沉淀
C. 最终出现灰绿色沉淀 D. 无变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法不正确的是( )
A. 常温常压下,2 g D2O 中含中子数为NA
B. 标况下,22.4L 己烷中碳原子数为6NA
C. 2.4g Mg 在空气中充分燃烧,转移的电子数为0.2NA
D. 28g乙烯和丙烯(C3H6)的混合气体含有的碳氢键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硫粉在过量的氧气中燃烧可以生成SO3
B.可以用澄清石灰水鉴别CO2和SO2
C.将少量CO2通入BaCl2溶液能生成白色沉淀
D.不能用排水法收集SO2、NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用氧化浓盐酸的方法制取氯气,实验装置如图所示:
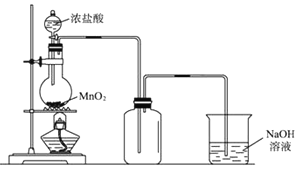
(1)写出制备氯气的离子方程式: ______ ;
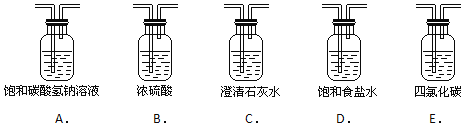
(2)为了得到纯净、干燥的氯气,此装置还需增加净化装置,请根据气体的流动方向,依次按顺序选择所用的装置,正确的选项是 ______ ;
(3)如果将过量二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有:① ______ ;② ______ .
(4)多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______ ;
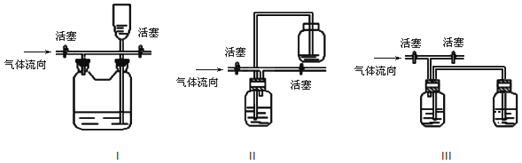
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com